
科目: 来源: 题型:
【题目】化合物X可用于合成Y.下列有关X、Y的说法正确的是( )
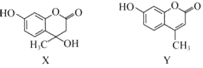
A. X分子中所有原子可能在同一平面上
B. X在一定条件下可以发生消去反应
C. Y与足量H2的加成产物中不含手性碳原子
D. X、Y与足量浓溴水反应的类型完全相同
查看答案和解析>>
科目: 来源: 题型:
【题目】在制蒸馏水的实验中,下列叙述正确的是( )
A. 在蒸馏烧瓶中盛约![]() 体积的自来水,并放入几粒沸石
体积的自来水,并放入几粒沸石
B. 将温度计插入液面以下,以随时测定烧瓶中液体的温度
C. 冷水从冷凝管上口入,下口出
D. 收集蒸馏水时,从开始馏出液体就收集
查看答案和解析>>
科目: 来源: 题型:
【题目】综合题
Ⅰ.现有失去标签的CaCl2、AgNO3、HCl和Na2CO3四瓶溶液。为了确定这四瓶溶液成分,将四瓶溶液成分别编号为A、B、C、D后进行化学实验,实验记录如下:
实验顺序 | 实验内容 | 实验现象 |
① | A+B | 无现象 |
② | B+D | 有气体放出 |
③ | C+B | 有沉淀生成 |
④ | A+D | 有沉淀生成 |
请根据上述实验填空:
(1)A、C两瓶溶液分别是(用化学式表示)_____、______。
(2)A、D溶液混合恰好完全反应生成白色沉淀,过滤、洗涤,再向滤渣中加入足量盐酸溶液,写出向滤渣中加人盐酸的离子方程式: ______。
Ⅱ.某固体混合物中,可能含有下列离子中的几种:K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-,将该混合物溶于水后得到澄清溶液,现取三份各100mL该溶液分别进行如下实验(已知:NH4++OH-NH3↑+H2O)。
(1)在一份溶液中加入AgNO3溶液,有白色沉淀生成。
(2)在另一份溶液中加入足量的NaOH 溶液并加热,收集到1.12L气体(标准状况下)。
(3)在第三份溶液中加入足量的BaCl2溶液后有沉淀生成,经称量其质量为6.27g,在该沉淀中加入足量的盐酸,沉淀部分溶解,剩余固体质量为2.33g。根据上述实验回答下列问题:
①溶液中一定不存在的离子是_______。
②溶液中一定存在的阴离子有______,其物质的量浓度分别为______ 。
③推断 K+是否存在并说理由:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,改变0.1mol·L-1H2SO3溶液的pH,各微粒的物质的量分数(α)变化如图所示,下列说法中错误的是
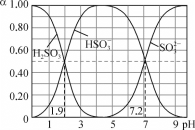
A. 1gK1(H2SO3)=-1.9
B. pH=3时,c(HSO3-)>c(H2SO3)>c(SO32-)
C. 反应H2SO3+SO32-![]() 2HSO3-的lgK=5.3
2HSO3-的lgK=5.3
D. pH=7.2时,c(HSO3-)=c(SO32-)=c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】(Ⅰ)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+NOCl(g) K1 ΔH1<0 (Ⅰ)
NaNO3(s)+NOCl(g) K1 ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2NOCl(g) K2 ΔH2<0 (Ⅱ)
2NOCl(g) K2 ΔH2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(NOCl)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________ mol,NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”),平衡常数K2________(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是____________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2 +2NaOH =NaNO3 +NaNO2 +H2O。含0.2 mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1 mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为_______________。(已知HNO2的电离常数Ka=7.1×10-4 mol/L,CH3COOH的电离常数Ka=1.7×10-5 mol/L)可使溶液A和溶液B的pH相等的方法是_____。
a.向溶液A中加适量水
b.向溶液A中加适量NaOH
c.向溶液B中加适量水
d.向溶液B中加适量NaOH
(Ⅱ)在恒压密闭容器中,充入一定量的H2和CO2 发生如下可逆反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH<0,实验测得反应物在不同温度下,反应体系中CO2的平衡转化率与压强的关系曲线如图所示。
CH3OH(g)+H2O(g)ΔH<0,实验测得反应物在不同温度下,反应体系中CO2的平衡转化率与压强的关系曲线如图所示。

(1)该反应的ΔS______0(填>或<),该反应在_______(填“低温”或“高温”)条件下利于自发进行;
(2)比较T1与T2的大小关系:T1__T2(填“<”、“=”或“>”),理由是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 在外加电流的阴极保护法中,须将被保护的钢铁设备与直流电源的负极相连
B. 反应H2S(g)+ZnO(s)===H2O(g)+ZnS(s)在一定条件下可自发进行,且ΔS<0,则ΔH>0
C. 常温常压,氢氧燃料电池工作消耗2.24 L O2时,转移电子的数目为0.4×6.02×1023
D. 常温下,Ksp[Cu(OH)2]=2.6×10-19,pH=10的含Cu2+的溶液中,c(Cu2+)≥2.6×10-11mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g);△H=-574kJmol-1
CH4(g)+2NO2(g)=N2(g) +CO2(g)+2H2O(g);△H=-867kJmol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=____________________
(2)利用氧化氮氧化物的流程如下:
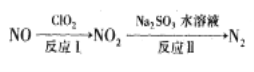
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为_____L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离程度_____(填“增大”、“减小”或“不变”);请写出Na2SO3溶液中,c(Na+)、c(H2SO3)、c(SO32-)、c(HSO3-)的大小关系:_____。
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8molL﹣1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入_____;为确保溶液中不出现浑浊,应调节溶液的pH不超过_____。(常温下,Ksp[Fe(OH) 2]=1.8×10﹣16)
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应:2A(g)+B(g)![]() 2C(g)ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是()
2C(g)ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是()
A. 若反应开始时容器体积为2L,则Vc=0.4molL-1min-1
B. 若在恒压绝热条件下反应,平衡后nc<1.6mol
C. 若2min后,向容器中再投入2mol A和1 mol B, B的转化率变大
D. 若该反应在恒温恒容下进行,放出热量将增加
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. SO2![]() CaSO3
CaSO3![]() CaSO4
CaSO4
B. Fe![]() Fe2O3
Fe2O3![]() FeCl3
FeCl3
C. HCl(aq) ![]() Cl2
Cl2![]() Ca(ClO)2
Ca(ClO)2
D. Cu2(OH)2CO3![]() CuO
CuO![]() CuCl2(aq)
CuCl2(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】室温时,CH3COOH的电离平衡常数为K,向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是( )

A. b点表示的溶液中c(Na+)>c(CH3COO﹣)
B. c点表示CH3COOH和NaOH恰好反应完全
C. d点表示的溶液中c(CH3COO﹣) c(H+)/c(CH3COOH)大于K
D. b、c、d三点表示的溶液中一定都存在:c(Na+)+c(H+)═c(CH3COO﹣)+c(OH﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com