
科目: 来源: 题型:
【题目】H2A为二元弱酸。20℃时,配制一组c(H2A)+c(HA﹣)+c(A2﹣)=0.100molL﹣1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
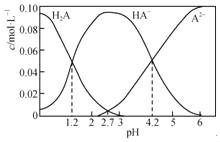
A. H2A的Ka1=10﹣1.2
B. pH=4.2的溶液中:c(HA﹣)=c(A2﹣)=0.050 molL﹣1
C. pH=7的溶液中:c(Na+)>2c(A2﹣)+c(H+)
D. c(Na+)=0.150 molL﹣1的溶液中:2c(OH﹣)+c(HA﹣)+3c(H2A)=2c(H+)+c(A2﹣)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度时,向容积为 2 L 的密闭容器中充入一定量的 SO2(g)和 O2(g),发生反应:2SO2(g) + O2(g) ![]() 2SO3(g) △H = -196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
2SO3(g) △H = -196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 前5 min的平均反应速率为υ(SO2) = 0.08 mol/(L·min)
B. 保持温度不变,向平衡后的容器中再充入 0.2 mol SO2(g)和0.2 mol SO3(g)时,υ正> υ逆
C. 相同温度下,起始时向容器中充入 1.5 mol SO3(g),达到平衡状态时 SO3 的转化率为40%
D. 保持其他条件不变,若起始时向容器中充入 2 mol SO3(g),达到平衡状态时吸收 78.4 kJ 的热量
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述正确的是( )
A.  若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右
若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右
B.  表示反应4CO(g)+2NO2(g)N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
表示反应4CO(g)+2NO2(g)N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
C.  表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数
表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数
D.  表示25℃时,向0.1 molL﹣1的NH4Cl溶液中滴加0.1 molL﹣1的盐酸,溶液中c(H+)/c(NH4+)随盐酸体积的变化关系
表示25℃时,向0.1 molL﹣1的NH4Cl溶液中滴加0.1 molL﹣1的盐酸,溶液中c(H+)/c(NH4+)随盐酸体积的变化关系
查看答案和解析>>
科目: 来源: 题型:
【题目】粗盐中常含有少量的泥沙及氯化钙、氯化镁、硫酸盐等一些可溶性的杂质。粗盐的提纯实验操作步骤如图所示:
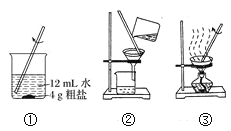
(1)请写出图中各步实验操作的名称②_____,③______。
(2)实验操作②的主要目的是______。
(3)实验操作①②③中都使用的仪器是_____,它在③中其作用是_____。
(4)通过上述实验操作,得到的精盐中可能含有的杂质是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是______(填编号)。若测定结果偏高,其原因可能是________(填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.所配的标准NaOH溶液物质的量浓度偏大
(2)判断滴定终点的现象是_____________________________________。
(3)如图是某次滴定时的滴定管中的液面,其读数为________mL。

(4)根据下列数据,请计算待测盐酸的浓度:________mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目: 来源: 题型:
【题目】计算:
(1)用14.2g无水硫酸钠配制成500mL溶液,其物质的量浓度为____mol·L-1。
(2)若从中取出50mL,其物质的量浓度为____mol·L-1;溶质的质量为___g。
(3)若将这50mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为____mol·L-1,SO42-的物质的量浓度为_____mol·L-1。
(4)已知:a g某气体A含有b个分子,则c g该气体在标准状况下的体积为____ L。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 常温常压下,11.2L二氧化硫所含的氧原子数等于NA
B. 0.5molH2O所含的电子数为9NA
C. 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA
D. 300mL2mol·L-1蔗糖溶液中所含分子数为0.6NA
查看答案和解析>>
科目: 来源: 题型:
【题目】“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究。
探究氰化物的性质:已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
25℃电离平衡常数 | Ki=1.77×10﹣4 | Ki=5.0×10﹣10 | Ki1=4.3×10﹣7 Ki2=5.6×10﹣11 |
(1)NaCN溶液呈碱性的原因是________________________ (用离子方程式表示)
(2)如图表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是_________

A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(CN﹣)>c(HCOO﹣)>c(OH﹣)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:CN﹣+CO2+H2O=HCN+CO32﹣
C.图像中a点酸的总浓度小于b点酸的总浓度
D.c点溶液的导电性比a点溶液的导电性弱
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为_____。
(4)下列四种离子结合H+能力由弱到强的是______________________________________。
A. HCOO- B. CN- C. CO32- D.HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com