
科目: 来源: 题型:
【题目】下列应用与盐的水解无关的是( )
A. NH4Cl与ZnCl2溶液可作焊接中的除锈剂
B. 用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
C. 氯化钠可用作防腐剂和调味剂
D. 实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
查看答案和解析>>
科目: 来源: 题型:
【题目】废水中过量的氨氮(NH3和NH4+)会导致水体富营养化。某科研小组用NaClO氧化法处理氨氮废水。已知:①HClO的氧化性比NaClO强;②NH3比NH4+更易被氧化;③国家标准要求经处理过的氨氮废水pH要控制在6~9。
(1)pH=1.25时,NaClO可与NH4+反应生成N2等无污染物质,该反应的离子方程式为_____。
(2)进水pH对氨氮去除率和出水pH的影响如下图所示

①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降的原因是_____
②进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是_____
③进水pH应控制在_____左右为宜。
(3)为研究空气对NaClO氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是_____(填字母)。
a.O2的氧化性比NaClO弱 b.O2氧化氨氮速率比NaClO慢
c.O2在溶液中溶解度比较小 d.空气中的N2进入溶液中
(4)利用微生物燃料电池可以对氨氮废水进行处理,其装置如图所示。闭合电路后,负极室与正极室均产生氮气,则负极室中NH4+发生反应的电极反应式为_____。该装置除了能对氨氮废水进行处理外,另一个突出的优点是_____。
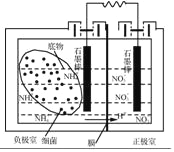
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,下列说法正确的是( )
CH3COOH+OH-,下列说法正确的是( )
A. 稀释溶液,溶液的pH增大 B. 加入少量NaOH固体,c(CH3COO-)减小
C. 温度升高,c(CH3COO-)增大 D. 加入少量FeCl3固体,c(CH3COO-)减小
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g)![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=_________。分别在v L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
(2)CO2可以被NaOH溶液捕获。
①若所得溶液pH=13,CO2主要转化为_______(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×107;K2=5×1011)
②当2molCO2通入3molNaOH被吸收时,溶液中离子浓度关系正确的是(选填字母)________。
a.c(Na+)+c(H+)=c(CO32)+c(HCO3-)+c(OH-)
b.c(Na+)>c(HCO3-)>c(CO32)> c(OH-)>c(H+)
c.3c(Na+)=2[c(CO32)+c(HCO3-) +c(H2CO3)]
(3)CO2辅助的CO—O2燃料电池,工作原理如图所示,固体介质中CO32— 可定向移动。电池的负极反应式:________________________________电池工作时需向某电极通入CO2以触发反应,该电极为_____________(填“甲”或“乙”)

查看答案和解析>>
科目: 来源: 题型:
【题目】为了延长水果的保鲜期,下列的水果存放方法最合适的是
A.放入敞口的容器中 B.放入浸泡过高锰酸钾溶液硅土的密封容器中
C.放入密封的容器中 D.放入充有少量乙烯的密封容器中
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式属于盐的水解,且书写正确的是( )
A. NaHCO3溶液:HCO3—+H2O ![]() CO32—+H3O+
CO32—+H3O+
B. NaHS溶液:HS-+H2O![]() H2S+OH-
H2S+OH-
C. Na2CO3溶液:CO32—+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. KF溶液:F-+H2O = HF+OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯是合成纤维、合成橡胶、合成塑料、合成乙醇的基本化工原料。回答下列问题:
(1)实验室快速制取少量乙烯可用乙烯利(![]() )与NaOH溶液反应制取。写出该反应的化学方程式为________(磷转化为磷酸正盐)。
)与NaOH溶液反应制取。写出该反应的化学方程式为________(磷转化为磷酸正盐)。
(2)乙烷裂解制备乙烯越来越受到石化企业的重视。已知部分热化学方程式如下:
Ⅰ.C2H6(g)=C2H4(g)+H2(g) △H1=+137kJ·mol-1
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+42kJ·mol-1
Ⅲ.C2H6(g)+CO2(g)=C2H4(g)+CO(g)+H2O(g) △H3
①反应Ⅲ的△H3=________kJ·mol-1。
②若在1273K时,100kPa下反应(Ⅰ)达到平衡时,混合气体中C2H4、C2H6、H2的物质的量分别为0.047、0.006、0.047,则乙烯的分压为p(C2H4)=________kPa;平衡常数Kp=________(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
③恒温恒容密闭容器中进行的反应(Ⅱ),能说明已达到平衡状态的是________(填字母)。
a.压强不再随时间变化 b.混合气体密度不再随时间变化
c.v(H2)正=v(CO)逆 d.单位时间内断裂C=O的数目与断裂H-O的相等
④乙烷直接裂解以及与CO2耦合裂解可能发生的反应及平衡转化率(α)与温度(T)的关系分别如下图所示,已知:a.C2H6=C2H4+H2;b.C2H6+CO2=C2H4+CO+H2O;c.C2H6+2CO2=4CO+H2;d.2C2H6+CO2=C2H4+2CO+2H2+CH4;e.16C2H6+9CO2=14C2H4+12CO+12H2+6H2O+CH4。

下列说法正确的是________(填字母)。
a.600℃以下,反应a的趋势最大
b.CO2和C2H6耦合裂解有利于提高乙烷的平衡转化率
c.过量CO2和C2H6耦合高温裂解,可较好防止催化剂表面结炭
d.用合适的催化剂催化CO2和C2H6耦合裂解,可提高反应平衡常数
(3)以太阳能电池为电源,利用电解法也可实现CO2制备乙烯,其装置如图所示。电极a为电源的________(填“正极”或“负极”),生成乙烯的电极反应式为________。

查看答案和解析>>
科目: 来源: 题型:
【题目】自然界的矿物、岩石的成因和变化受多种条件的影响。地壳内每加深1![]() ,压强增大约25000~30000KPa,温度升高25—30摄氏度。在地壳内SiO2和HF存在以下平衡: SiO2(s)+4HF(g)
,压强增大约25000~30000KPa,温度升高25—30摄氏度。在地壳内SiO2和HF存在以下平衡: SiO2(s)+4HF(g) ![]() SiF4(g)+2H2O(g) + 148.9KJ
SiF4(g)+2H2O(g) + 148.9KJ
根据题意完成下列填空:
(1)该反应的△H________0,在地壳深处容易有____________气体逸出,已知此处温度较高,则该反应为 _____________反应(填“自发”,“非自发”,“无法确定”)
(2)如果上述反应的平衡常数K值变大,该反应__________(填编号)。
A.一定向正反应方向移动
B.正逆反应速率一定加快
C.平衡移动过程为:正反应速率先增大后减小
D.平衡移动过程为:逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应已经达到平衡时,下列成立的是_______ (填编号)。
a.2 v正(HF) = v逆(H2O) b. v (H2O) = 2v (SiF4)
c. SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应容器容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】把一块锌片和一块铜片平行地插入盛有稀硫酸溶液的烧杯中,观察到的现象是________,再用导线把锌片和铜片连接起来,在导线中间接入灵敏电流计,灵敏电流计上观察到的现象是________;该原电池中电子流动的方向是________,总反应的化学方程式是________,其中________元素被氧化,________极上发生还原反应;在上述化学方程式上方用单线桥标出电子转移的方向和数目。___________
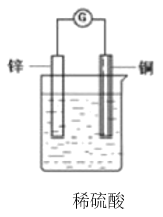
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
A. 溶液中导电粒子的数目增加,导电性增强
B. 醋酸的电离程度增大,pH增大
C. 再加入10mLpH=11NaOH溶液,混合液pH>7
D. 溶液中c(CH3COO—)/c(CH3COOH)c(OH—)变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com