
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
B. 标准状况下,2.24 L乙烷和丙烯的混合物中含氢原子数目为0.6NA
C. 将0.1 mol H2和0.2 mol I2(g)充入密闭容器中充分反应后,生成的H-I键数目为0.2NA
D. 常温下,电解1 L的精制食盐水,一段时间后测得溶液pH为11,则电解过程中通过导线的电子数目为0.002NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答下列问题:
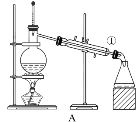
(1)从氯化钾溶液中得到氯化钾固体选择装置___(填代表装置图的字母,下同);除去自来水中的Cl-等杂质选择装置____。
(2)从碘水中分离出I2,选择装置___,该分离方法的名称为____。
(3)装置A中①的名称是____,进水的方向是____。装置B在分液时为使液体顺利滴下,应进行的具体操作是____。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如图流程的实验:
![]()
问题1:精盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是____(填字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
问题2:按所选顺序操作时,步骤④的化学方程式是____。
问题3:由海水到氯化钠晶体的实验过程中要用到的主要装置是___(从给定的四种装置中选择)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列烷烃:①正己烷 ②丙烷 ③正戊烷 ④正丁烷 ⑤癸烷中,沸点由高到低顺序正确的是( )
A. ①②③④⑤B. ⑤①③④②C. ⑤③④①②D. ③④⑤②①
查看答案和解析>>
科目: 来源: 题型:
【题目】工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。

(1)“酸浸”应选择_________(填标号);为提高酸浸率,可采取的措施_________(至少答两点)
a. 硫酸 b. 盐酸 c. 硝酸
(2)实验室要完成操作1需要的玻璃仪器有_________。
(3)加入H2C2O4溶液时,发生的反应为______+______TiCl4+_____H2C2O4+ _____H2O= BaTiO(C2O4)2·4H2O↓ + _________;可循环使用的物质X是(写名称)_________。
(4)请简述检验草酸氧钛钡晶体是否洗涤干净的方法_________。
(5)高温煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成的气体产物有CO、和_________。
(6)测定钛酸钡粉体中BaTiO3的质量分数。
已知:Ba2++CrO42-=BaCrO4↓ 2CrO42-+2H+=Cr2O72-+H2O
现取a g煅烧后的BaTiO3粉末酸溶得到100.0 mL含Ba2+的溶液,取25.00 mL于锥形瓶,加入x mL 浓度为C1 mol/L的Na2CrO4溶液(Na2CrO4过量)充分反应后,用浓度为C2 mol/L标准盐酸滴定至CrO42-被完全反应,消耗盐酸体积为y mL。(钛元素不干扰测定过程)已知BaTiO3的摩尔质量为M g/mol,试写出粉体中BaTiO3质量分数的表达式。_________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)现有以下物质:①NaCl晶体、②液态HCl、③CaCO3固体、④熔融KCl、⑤蔗糖、⑥铜、⑦CO2、⑧H2SO4。其中:属于电解质的是___,属于非电解质的是___(填序号)。
(2)丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1g·cm-3,沸点约为55 ℃,分离水和丙酮时最合理的方法是____。
a.蒸发 b.分液 c.过滤 d.蒸馏
(3)如图所示,过滤操作中的一处错误是__。

查看答案和解析>>
科目: 来源: 题型:
【题目】苦杏仁酸在医药工业可用于合成头孢羟唑、羟苄唑、匹莫林等的中间体,下列路线是合成苦杏仁酸及其衍生物的一种方法:

(1)试写出B的结构简式_____,C中官能团的名称为_____。
(2)反应①的反应类型为_____,D的核磁共振氢谱共有_____组峰。
(3)1molE最多可以与_____molNaOH反应。反应③的化学方程式为_____。
(4)两个C分子可以反应生成具有三个六元环的化合物F,则F的结构简式为_____。
(5)写出满足下列条件的C的同分异构体的结构简式_____。
A.既能发生银镜反应,又能发生水解反应
B.遇FeCl3能显紫色
C.苯环上具有两个位于对位的取代基
(6)已知:RCH2COOH![]() RCHClCOOH,请以冰醋酸为原料(无机试剂任选)设计制备聚乙醇酸(
RCHClCOOH,请以冰醋酸为原料(无机试剂任选)设计制备聚乙醇酸(![]() )的合成路线_____。
)的合成路线_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g)![]() 2NO(g) △H1=+183kJ/mol
2NO(g) △H1=+183kJ/mol
2H2(g)+O2(g)=2H2O(1) △H2=-571.6kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3=-1164.4kJ/mol
则N2(g)+3H2(g)![]() 2NH3(g) △H=________kJ/mol
2NH3(g) △H=________kJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料I | 1.0mol/L | 3.0mol/L | 0 |
投料II | 0.5mol/L | 1.5mol/L | 1.0mol/L |
①按投料I进行反应,测得达到化学平衡状态时H2的转化率为40%,若按投料II进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
②L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,合成氨反应中H2(g)的平衡转化率随X
的变化关系。
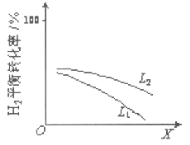
iX代表的物理量是_________,
ii判断L1、L2的大小关系,并简述理由:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】请根据表中的信息回答下列问题
元素 | A | B | C | D | E |
有关信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 其原子M层有3个电子 | 食盐中的金属元素 | 单质在常温、常压下是黄绿色的气体 |
(1)D离子的结构示意图:________,B原子的电子式:________,E离子的电子式:________。
(2)和B元素的氢化物所含电子数相同的分子有多种,写出任意2种:________,________。
(3)A元素与E元素组成的化合物的电离方程式:_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知阿伏伽德罗常数可表示为NA,则下列说法正确的是
A. 任何气体单质在标准状况下体积约为22.4L,则一定含有2NA个原子
B. 常温常压下,22g氧气和26g臭氧所含氧原子总数为3NA
C. 常温常压下,22.4LH2O中含有的氢原子数为2NA
D. 标准状况下,0.3molCO2中含有氧原子数0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com