
科目: 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:

请回答下列问题:
(1)写出实验流程中下列物质的化学式:
试剂X :______________ 沉淀A:______________ 沉淀B:________________。
(2)上述实验流程中加入过量的Na2CO3的目的是____________________________。
(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质。
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定某草酸晶体(H2C2O42H2O)样品的纯度,现称取一定质量的该样品,配制成100 mL溶液,取25.00 mL该溶液于锥形瓶中,加适量稀硫酸,用0.100 mol/L的KMnO4溶液滴定(杂质不参与反应)。为省去计算过程,当称取的样品的质量为某数值时,滴定所用KMnO4溶液的毫升数恰好等于样品中草酸晶体的质量分数的100倍。则应称取样品的质量为
A. 2.25 g B. 3.15 g C. 9.00 g D. 12.6 g
查看答案和解析>>
科目: 来源: 题型:
【题目】实验表明新型钠离子聚合物电池正负极材料均表现出较快的电极反应动力学,使得电池具备高功率性能。其放电时的工作原理如图,下列说法正确的是

A. 放电时,高聚物发生还原反应
B. 充电时,阳极的电极反应式为 3I- +2e-=I3-
C. 充电时,电极A接电源负极
D. 放电时,当转移0.5 mol电子,NaI溶液中增加0.5NA个Na+
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置。
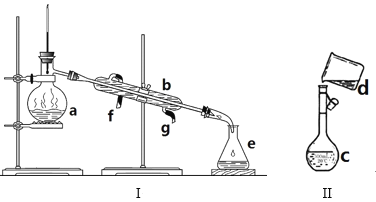
(1)写出下列仪器的名称:a、_____b、 _____
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是____,将仪器补充完整后进行实验,温度计水银球的位置在____处。冷凝水由____(填f或g)口通入,___口流出。
查看答案和解析>>
科目: 来源: 题型:
【题目】中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。完成下列填空:
实验 编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
I、(1)滴定达到终点的标志是是__________________。
(2)根据上述数据,可计算出该盐酸的浓度约为___________(保留小数点后3位)。
(3)排除碱式滴定管尖嘴中气泡的方法应采用________操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有___________。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥 C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视 E.碱式滴定管尖嘴部分有气泡,滴定后消失
II、(1)浓度为0.1mol/L醋酸钠溶液中质子守恒表达式为__________________;
(2)在0.01mol/L的NaHCO3溶液中的物料守恒表达式为___________________;
等浓度的NaHCO3 、Na2CO3混合溶液中的电荷守恒表达式为___________________;
(3)硫代硫酸钠(Na2S2O3)溶液与稀硫酸反应的离子方程式为____________________;
(4)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于有机物a( )、b(
)、b(![]() )、c(
)、c( )
)
A. a、b、c均能与溴水发生加成反应
B. a、b、c的分子式均为C8H8
C. a的所有原子一定处于同一一平面
D. b的二氯代物有3种
查看答案和解析>>
科目: 来源: 题型:
【题目】I.常温下0.1mol·L-1的盐酸和pH=1的醋酸各100mL分别与足量的锌粒反应,产生的气体前者比后者_____(填“>”“<”或“=”)。
II.现有常温下pH=2的HCl溶液甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是_____。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)c(OH-) D.c(OH-)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡________(填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将________(填“增大”“减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)__ V(乙) (填“>”“<”或“=”)。
(4)已知25℃时,下列酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=4.7×10-11 | 3.0×10-8 |
下列四种离子结合H+能力最强的是________。
A.HCO3— B.CO32— C.ClO- D.CH3COO-
写出下列反应的离子方程式:HClO+Na2CO3(少量):______________________。
Ⅲ.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:

(1)点③所示溶液中所有离子的浓度由大到小的顺序为:_____________________。
(2)点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4)+c(C2O42)=________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组中,两种气体的分子数一定相等的是 ( )
A. 温度相同、体积相同的O2和N2 B. 体积相等、密度不等的CO和C2H4
C. 质量相等、密度不等的CO和C2H4 D. 压强相同、体积相同的O2和N2
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列溶液中的微粒浓度关系不正确的是
A. pH=8.3的某酸式盐NaHB的水溶液中:c (Na+) > c (HB-) > c (H2B) > c (B2-)
B. 等物质的量浓度的Na2S和NaHS溶液中:c (Na+)=2c (S2-) + c (HS-)
C. NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c (Na+) > c (SO42-) > c (NH4+) > c (OH-)=c (H+)
D. 0.1 mol / L NaH2PO4溶液中:c (Na+)=c (PO43-) + c (HPO42-) + c (H2PO4-) + c (H3PO4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com