
科目: 来源: 题型:
【题目】根据下列五种短周期元素的电离能数据(单位:kJ/mol),回答下面各题。
元素代号 | I1 | I2 | I3 | I4 | I5 |
Q | 800.6 | 2427.1 | 3659.7 | 25025.8 | 32826.7 |
R | 495.8 | 4562 | 6910.3 | 9543 | 13354 |
S | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 |
T | 1402.3 | 2856 | 4578.1 | 7475.0 | 9444.9 |
U | 2080.7 | 3952.3 | 6122 | 9371 | 12177 |
(1)在这五种元素中,最可能处于同一族的两种元素是_________(填元素符号),S元素最可能是_____区元素
(2)基态Q元素原子的价电子排布式是____________。Q和T同周期。化合物QT中T元素的化合价为_______;第一电离能介于Q、T之间的同周期元素有______种。
(3)化合物RT3中化学键类型为_______,RT3的阴离子的几何构型为________。
(4)下列元素中,化学性质和物理性质最像U元素的是_____________
A.硼 B.铍 C.锂 D.氦 E.碳
(5)R的某种氧化物X晶胞结构如图所示,晶胞参数a=0.566 nm,X的化学式为_____;列式并计算晶体X的密度(g·cm-3)_____。

查看答案和解析>>
科目: 来源: 题型:
【题目】锗是重要的稀缺战略资源,广泛应用于众多国防军工及民用领域,属于我国战略收储金属。某科研课题采用的提取锗技术路线为:低品位锗精矿-(次亚磷酸钠热还原-真空挥发富集)-挥发产物高品位还原锗精矿-碱氧化预处理-盐酸蒸馏提纯-高纯四氯化锗-高纯二氧化锗。

(1)在周期表中金属与非金属的分界处,可以找到半导体材料,如Si、 等,半导体器件的研制正是开始于 ,后来发展到研制与它同族的 。三种元素依次是_______(填标号)。
a.Ge Si Ge
b.Ge Ge Si
c.C Si Ge
(2)请配平次亚磷酸钠热还原反应的化学方程式并在括号内注明反应条件:
___NaH2PO2·H2O+GeO2 ![]() ___Na4P2O7+___H2O+___GeO↑+___H3PO4,_____________
___Na4P2O7+___H2O+___GeO↑+___H3PO4,_____________
(3)高品位还原锗精矿碱氧化预处理过程的产物是锗酸钠,请写出该过程的化学反应方程式:____________________________________________
(4)高纯二氧化锗含量采用碘酸钾滴定法进行分析。称取3.600g高纯二氧化锗样品,采用氢氧化钠在电炉上溶样,次亚磷酸钠加热还原,然后以淀粉为指示剂,用碘酸钾标准溶液(0.6000mol/L)滴定,消耗的碘酸钾体积为19.00mL。[20℃以下,次亚磷酸钠不会被碘酸钾和碘氧化]
①滴定终点的现象是_____________________________。
②此样品中二氧化锗含量是_________。(保留四位有效数字)
(5)用氢气还原GeO2可制得金属锗。其反应如下:
GeO2+ H2= GeO+ H2O ①
GeO+ H2= Ge+ H2O ②
GeO2+ 2H2= Ge+ 2H2O ③
反应式③ΔH=+13750 kJ/mol ,ΔS=+15600J/(K·mol),则还原反应的温度一般控制在_________℃范围内。[已知GeO在700℃会升华,T(K)=t(℃)+273]
(6)锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有一最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时_________加剧所致。

查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、Ⅹ、Y、Z的原子序数依次增加,X的质子数是W与Z的质子数之和的一半。m、n、p是由这些元素组成的二元化合物,r是元素Y的气体单质,n为淡黄色粉末,相关物质转化关系如图所示。室温下,0.01mol/Ls溶液pH为12。下列说法正确的是
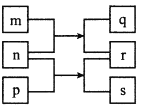
A. 原子半径大小:W<X<Y B. 简单离子半径大小:Y<Z
C. 简单氢化物沸点高低:Z<Y<X D. Y、Z形成的化合物均含离子键
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中充入一定量的H2和N2,经测定反应开始后3s内v(N2)=0.2 mol·L-1·s-1,则3s末NH3的浓度为
A.0.4 mol·L-1B.0.6 mol·L-1C.0.9 mol·L-1D.1.2 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】图为元素在生物体内的含量分布情况,下列表述错误的是

A. P、S、K、Ca、Zn属于大量元素
B. 在非生物界中都能找到,体现生物界与非生物界的统一性
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不能够用勒夏特勒原理来解释的是
A. 实验室用排饱和食盐水的方法收集氯气
B. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
C. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
D. 恒温、恒压条件下,在2NO2![]() N2O4平衡体系中充入He后,体系颜色变浅
N2O4平衡体系中充入He后,体系颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】一个密闭容器,中间有一无摩擦、可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变)。
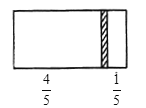
(1)右边气体的物质的量为___。
(2)右边气体中CO和CO2的质量之比为__。
(3)若改变右边CO和CO2的充入量而使隔板处于距离右端1/3处,保持温度不变,则前后两次充入情况容器内的压强之比为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】若实行海水淡化来供应饮用水,下列方法在原理上完全不可行的是( )
A. 加入明矾,使海水的盐分沉淀而淡化
B. 利用太阳能,将海水蒸馏淡化
C. 利用半透膜,采用反渗透法而使海水淡化
D. 将海水通过离子交换树脂,以除去所含的盐分
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组进行粗盐(含有少量氯化钙和硫酸镁杂质)提纯实验,请结合实验过程回答下列问题:
(1)步骤一:称取10g粗盐,倒入烧杯中后加入30mL水溶解。为加快溶解速率,可采取的方法是________(任写1种)
(2)步骤二:依次加入稍过量的沉淀剂,充分反应后得到大量沉淀。沉淀剂加入顺序依次为(用化学式表示)___________________________。
(3)步骤三:将混合物进行过滤,取滤液进行下一步操作。步骤四:往滤液中加入适量的________(填试剂名称),调节pH到7(用pH试纸测定),若该试剂不小心加过量,对所得到氯化钠的纯度________(填“有”或“没有”)影响。
(4)步骤五:将滤液倒入________中进行加热,等到______________________时,停止加热,利用余热蒸干。
步骤六:晶体转入试剂瓶中待用。
(5)在步骤三和五中,玻璃棒的作用依次是________、________。
(6)最终得到的氯化钠固体中还含有微量的NaBr和KCl,更简单的除杂方法是________。
(7)已知氯元素的近似相对原子质量为35.5,由![]() Na、
Na、![]() Cl、
Cl、![]() Cl构成的11.7 gNaCl中含有
Cl构成的11.7 gNaCl中含有![]() ________克。
________克。
查看答案和解析>>
科目: 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
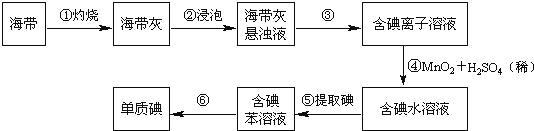
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_______(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是_______。在分液操作中,应充分振荡,然后静置,待分层后______(填标号),以下略。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com