
科目: 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:N2(g)+O2(g)===2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)===2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)===4NO(g)+6H2O(l) ΔH=c kJ·mol-1
反应8NH3(g)+6NO2(g)===7N2(g)+12H2O(l) ΔH=____kJ·mol-1。
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图1所示。写出该图示的总反应化学方程式:______________________。该反应需控制温度,温度过高时氨氮去除率降低的原因是________________________________________________________________________。
 图1
图1 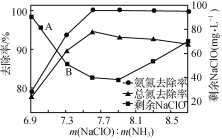 图2
图2

②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图2所示。点B剩余NaClO含量低于点A的原因是____。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是____。
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如图3所示。
①写出该活性原子与NO3-反应的离子方程式:________________。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为____mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用如图所示的实验装置研究气体X的性质。气体X的主要成分是氯气,其中还含有水蒸气。请回答下列问题:
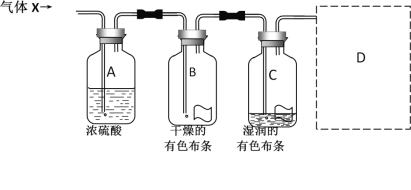
(1)该实验的主要目的是__________________________。
(2)与实验目的直接相关的实验现象是_________________________。
(3)图中所示的实验设计还存在不足。请根据相关物质的性质,在图中的D处画图补充有关实验装置和所用试剂。_______
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.(1)某校研究性学习小組的学生欲制取、收集氨气,并探究氨气的有关性质,请你参与回答实验中的有关问题。
①要收集较纯的干燥氨气,使用的收集方法是____________________。
②甲、乙两小组的学生用相同容积的圆底烧瓶各收集一瓶干燥氨气,进行实验,结果都产生了喷泉,说明氨气_____________溶于水。
(2)某兴趣小组为验证SO2和Cl2的漂白性,设计了如下方案,请你参与回答下列问题(尾气处理装置未画出)。

①如图甲所示,向品红溶液中通入SO2,同学们发现品红溶液褪色了,停止通气体,加热试管,发现溶液又变为红色,说明SO2的漂白是___________________(填“可恢复的”或“不可恢复的”)。
②如图乙所示,将干燥的Cl2和SO2按其体积比1:1混合,通入石蕊溶液中,发现石蕊溶液变红,但不褪色,试用化学方程式解释之:_____________________________________________________________。
Ⅱ.某小组同学为了获取在Fe(OH)2制备过程中,沉淀颜色的改变与氧气有关的实验证据,用图1所示装置进行了如下实验(夹持装置已略去,气密性已检验)。

(进行实验)
实验步骤:(1)Ⅰ向瓶中加入饱和FeSO4溶液,按图1所示连接装置;
(2)打开磁力搅拌器,立即加入10% NaOH溶液;
(3)采集瓶内空气中O2含量和溶液中O2含量(DO)的数据。
实验现象:生成白色絮状沉淀,白色沉淀迅速变为灰绿色,一段时间后部分变为红褐色。
实验数据:

(解释与结论)
(1)搅拌的目的是________________________________________________________。
(2)生成白色沉淀的离子方程式是__________________________________________。
(3)红褐色沉淀是________________________。
(4)通过上述实验,可得到“在Fe(OH)2制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是_____________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】自然界的氮循环如图所示。下列说法中,不正确的是( )

A. 工业合成氨属于人工固氮
B. 雷电作用下N2与O2发生化学反应
C. 在氮循环过程中不涉及氧化还原反应
D. 含氮无机物与含氮有机化合物可相互转化
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)实验室常用浓硫酸的质量分数为98%,密度为1.80 g·mL1,其物质的量浓度是_______。
(2)标准状况下,将V L A气体(摩尔质量为M g/mol)完全溶于0.1 L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为_______mol/L。
A.Vd/(MV+2240) B.1000Vd/(MV+2240) C.1000VdM/(MV+2240) D.MV/22.4(V+0.1)d
查看答案和解析>>
科目: 来源: 题型:
【题目】把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含bmolBaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的物质的量为
A. (b-a)molB. (2b-a)molC. 2(b-a)molD. 2(2b-a)mol
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.实验室需要0.1 mol·L1NaOH溶液500 mL。根据溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________________。

(2)配制时,其正确的操作顺序是__________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;
④使用之前要检查是否漏水。这些叙述中正确的是__________(填字母)。
A.①②③④ B.②③ C.①②④ D.②③④
(4)根据计算用托盘天平称取的NaOH固体质量为______g。
Ⅱ.配制1 mol/L的稀硫酸溶液500 mL。回答下列问题。
(5)需要质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为_________mL(计算结果保留一位小数)。如果实验室有25 mL、50 mL、10 0mL量筒,应选用________mL规格的量筒最好。
(6)下面操作造成所配稀硫酸溶液浓度偏高的是______(填字母)。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】在保证安全的前提下,学以致用是我们化学学习中一直倡导的理念。某同学欲用NaOH固体配制480 mL质量分数为25%,密度为1.2 g·cm-3的溶液,下列说法不正确的是( )
A. 需用托盘天平称量NaOH固体的质量为144 g
B. 容量瓶用蒸馏水洗净后,不必烘干就能用于配制溶液
C. 定容时俯视容量瓶的刻度线,会造成所配制溶液物质的量浓度偏高
D. 该溶液的物质的量浓度约为7.5 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要80 mL 1 mol·L1的稀硫酸,要用98%的浓硫酸(密度为1.84 g·cm3)来配制。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒 ⑧80 mL容量瓶。按使用仪器的先后顺序排列正确的是
A. ④③⑦⑧⑥ B. ②⑤⑦⑥ C. ①③⑧⑥⑦ D. ②⑥③⑦⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】从海水中提取并制备碳酸锂,可以提高海水的综合利用价值,满足工业上对碳酸锂的需求。制备碳酸锂的一种工艺流程如下:

已知:①海水中某些离子浓度如下:
离子 | Li+ | Mg2+ | Ca2+ | Mn2+ | Cl- |
浓度(mol/L) | 0.113 | 0.049 | 0.001 | 0.010 | 0.501 |
②碳酸锂的溶解度:
温度(℃) | 0 | 10 | 30 | 50 | 70 | 90 |
溶解度(g/L) | 1.54 | 1.43 | 1.25 | 1.08 | 0.91 | 0.83 |
![]() 几种难溶电解质的溶度积(25℃):
几种难溶电解质的溶度积(25℃):
物质 | Li2CO3 | MgCO3 | MnCO3 | CaCO3 | Mg(OH)2 |
Ksp | 2.5×10-2 | 6.8×10-6 | 2.3×10-11 | 2.8×10-9 | 6×10-10 |
请回答下列问题:
![]() 精制除杂阶段的滤渣为MgCO3、______
精制除杂阶段的滤渣为MgCO3、______![]() 写化学式
写化学式![]()
![]() 用HCl调pH为4~5的目的是_________。
用HCl调pH为4~5的目的是_________。
![]() 二次除镁过程中,若使Mg2+浓度为6×10-4mol/L,应控制pH为______。
二次除镁过程中,若使Mg2+浓度为6×10-4mol/L,应控制pH为______。
![]() 沉锂阶段,实际测得不同纯碱加入量条件下的碳酸锂沉淀结果如下表:
沉锂阶段,实际测得不同纯碱加入量条件下的碳酸锂沉淀结果如下表:
序号 |
| 沉淀质量(g) | Li2CO3含量(%) | 锂回收率(%) |
0.9:2.0 | 10.09 | 92.36 | 77.67 | |
1.0:2.0 | 10.97 | 90.19 | 82.46 | |
1.1:2.0 | 11.45 | 89.37 | 85.27 | |
1.2:2.0 | 12.14 | 84.82 | 85.85 |
综合以上信息及考虑实际生产时的原料成本,应按照______![]() 填序号
填序号![]() 中CO32-与Li+物质的量之比加入纯碱制备碳酸锂。
中CO32-与Li+物质的量之比加入纯碱制备碳酸锂。
![]() 沉锂温度需控制在
沉锂温度需控制在![]() ,主要原因是______。
,主要原因是______。
![]() 碳化分解具体过程为:①向碳酸锂与水的浆料中通入CO2气体,充分反应后,过滤;②加热滤液使其分解。写出②反应中的化学方程式:__________。写出在碳化分解中可循环利用物质的电子式:_________。
碳化分解具体过程为:①向碳酸锂与水的浆料中通入CO2气体,充分反应后,过滤;②加热滤液使其分解。写出②反应中的化学方程式:__________。写出在碳化分解中可循环利用物质的电子式:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com