
科目: 来源: 题型:
【题目】钛及钛合金在航空航天领城具有重要的应用价值。钛铁矿主要成分为钛酸亚铁(FeTiO3),另含有少量SiO2、Fe2O3等杂质。以钛铁矿为原料制备钛的工艺流程如下图所示。

(1)为提高钛铁矿酸浸时的浸出率,除了采用循环浸取、延长时间、熔块粉碎外,还可以采用______________________(写一种方法)。
(2)硫酸质量分数对钛、铁浸出率的影响如图所示,据此判断,酸浸时所加硫酸的质量分数应为___________。

钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式:______________________。
(3)查阅资料可知:TiO2+与Fe3+水解转化为沉淀的pH接近;反应①Fe3++H2Y2===FeY-+2H+,K=1024.3);反应②TiO2++H2Y2-=== TiO Y2-+2H+,K=1017.3。含钛铁溶液经EDTA(H2Y2-)处理后再调节pH,TiO2+水解生成偏钛酸[TiO (OH)2]沉淀,则TiO2+水解的离子方程式为:___________;Fe3+未转化为沉淀的原因是______________________。
(4)若将滤液2经___________冷却结晶、过滤一系列操作还可获得副产品绿矾(FsO4·7H2O)。滤液2经处理后,还可返回流程中使用的物质是______________________。
(5)利用下图所示装置在一定条件下由TiO2制取金属钛的化学方程式为__________________。阳极的电极反应式为______________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】苯达莫司汀(Bendamustine)是一种抗癌药物。苯达莫司汀的一种合成路线如下:


(1) D中含氧官能团有酰胺键、____(填名称)。
(2) A→B的反应类型为____。
(3) E的分子式为C12H13N3O4,写出E的结构简式:__________。
(4) G是 的同分异构体,G能发生银镜反应,分子中只有2种不同化学环境的氢。写出一种符合条件的G的结构简式:__________。
的同分异构体,G能发生银镜反应,分子中只有2种不同化学环境的氢。写出一种符合条件的G的结构简式:__________。
(5)已知: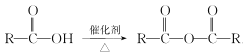 。请写出以
。请写出以![]() 乙醇为原料制备
乙醇为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)__________________________。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各2 mol充入某10 L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 10 | 12 |
n(Y)/mol | 1.40 | 1.10 | 0.40 | 0.40 |
下列说法正确的是
A. 反应前2 min 的平均速率v(Z)=3.0xl0-2 mol L-1min-1
B. 该温度下此反应的平衡常数K=64
C. 平衡后其他条件不变,再充入2 mol Z,新平衡时X的体积分数增大
D. 反应进行到10 min时保持其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
查看答案和解析>>
科目: 来源: 题型:
【题目】肉桂酸为微有桂皮香气的无色针状晶体,能抑制黑色酪氨酸酶的形成,是高级防晒霜中不可少的成分之一。实验室制取肉桂酸的原理如下:

实验步骤:
步骤1 在图1所示装置(夹持与加热仪器未画出,下同)的三颈烧瓶内加入K2CO3、苯甲醛(油状物)和乙酸酐,混合均匀后,在170 ℃~180 ℃加热反应1 h,冷却。
 图1
图1  图2
图2  图3
图3
步骤2 向三颈烧瓶内分批加入20 mL水和Na2CO3固体,调节溶液pH约为8。
步骤3 在三颈烧瓶中加入活性炭,用图2所示水蒸气蒸馏装置蒸馏除去未反应的苯甲醛。
步骤4 将三颈烧瓶内反应混合物趁热过滤,滤液冷却至室温,用浓盐酸酸化至pH=3,析出大量晶体,抽滤。并用少量冷水洗涤晶体。
步骤5 将晶体在图3所示热水浴上加热干燥。
(1)图1中仪器A的作用是____________。
(2)步骤2中Na2CO3需分批加入的原因是_________________________________________________。
(3)水蒸气蒸馏时,判断蒸馏结束的方法是________。
(4)步骤4中,“趁热过滤”的目的是_____________。
(5)抽滤时所需主要仪器有____、安全瓶及抽气泵等。
(6)与使用烘箱烘干相比,热水浴干燥的优点是___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一体积可变的容器中进行。下列条件的改变对其化学反应速率几乎没有影响的是:①增加C的用量;②将容器体积缩小一半;③保持容器体积不变,充入氮气使容器内压强增大;④保持压强不变,充入氮气使容器的体积变大
CO(g)+H2(g)在一体积可变的容器中进行。下列条件的改变对其化学反应速率几乎没有影响的是:①增加C的用量;②将容器体积缩小一半;③保持容器体积不变,充入氮气使容器内压强增大;④保持压强不变,充入氮气使容器的体积变大
A. ②④ B. ①③ C. ③④ D. ①④
查看答案和解析>>
科目: 来源: 题型:
【题目】根据元素周期律的变化规律,下列比较中,正确的是( )
A. 酸性:H2CO3>HNO3>H3PO4B. 氧化性:N2>O2>F2
C. 原子半径:Br>Cl>FD. 金属性:Al>Ng>Na
查看答案和解析>>
科目: 来源: 题型:
【题目】将4molA气体和2molB气体在2 L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g) ![]() 2C(g)。若经2 s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1 ;
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1;
③2s时物质A的转化率为30% ;
④2s时物质B的浓度为1.4mol·L-1。
其中正确的是( )
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将20.0g质量分数为14%的KNO3溶液与30.0g质量分数为24%的KNO3溶液混合,得到密度为1.15g/cm3的混合溶液。计算:
(1)混合后溶液中KNO3的质量分数为____,物质的量浓度为_____。
(2)在1000g水中需溶解____molKNO3才能使其浓度恰好与上述混合溶液的浓度相等。
(3)标准状况下44.8LHCl溶于水配成500mL溶液。则其浓度为_____,100mL该溶液与足量NaHCO3反应,生成气体在标准状况下为_____L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
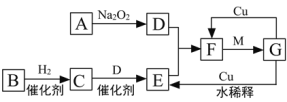
(1)物质G的化学式:__________________。
(2)物质B的名称:____________________。
(3)写出A→D的化学方程式:_______________________________________________;
F→G的化学方程式:______________________________________________________;
G→E的离子方程式:______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)现有下列4种物质:①NO、②Cl2、③浓H2SO4、④NH4HCO3。其中,受热易分解的是______________;(填序号,下同);可作氧气干燥剂的是______________;属于氧化物的是______________。
(2)选择装置,完成实验。
|
|
|
A | B | C |
①用CCl4萃取碘水中的I2,选用_________________(填序号,下同)。
②配制100 mL 0.50 mol/L NaOH溶液,选用_________________。
③从NaCl溶液中获取NaCl固体,选用____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com