
科目: 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列叙述正确的是
A. 1 mol Na2O2晶体中共含有4NA个离子
B. 标准状况下,22.4LCH3OH含有NA个分子
C. 常温下,1LpH=1的H2SO4溶液中,含有0.2NA个H+
D. 标准状况下,22.4LN2和O2的混合气体中含有的原子数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,不正确的是( )
A. 浓硫酸可以作CO2 、Cl2气体的干燥剂
B. 浓HNO3与金属反应时,HNO3常被还原为NO2
C. 实验室中浓硝酸要在棕色试剂瓶中密封保存,并放在阴凉处
D. 常温时,可以用铁制容器储存浓盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】能源危机当前是一个全球性问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是_____(填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源、不使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,金刚石和石墨相比较,_____填“金刚石”或“石墨”)更稳定,石墨的燃烧热为ΔH=_____。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为_________kJ。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ·mol-1。NO分子中化学键的键能为_____。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1000mL、密度1.192g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为_____mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中____L的CO2(标准状况)而变质。(已知:CO2+2NaClO+H2O=Na2CO3+2HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480mL含25%NaClO的消毒液。下列说法正确的是____。

A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143g
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L1(保留小数点后两位),该气体的相对分子质量为________。
(3)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是________,CO的体积分数是________,CO的质量分数是________,C和O原子个数比是________,混合气体的平均相对分子质量是________,密度是________g·L1。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A. CO32-+H2O![]() HCO3-+OH- 热的纯碱溶液清洗油污
HCO3-+OH- 热的纯碱溶液清洗油污
B. Al3++3H2O![]() Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
C. TiCl4+(x+2)H2O(过量) ![]() TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
D. SnCl2+H2O![]() Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入用待测液润洗过的锥形瓶中,并加入3滴甲基橙溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号)________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入______中。(从图中选填“甲”或“乙”)

(3)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_______________。
(4)判断到达滴定终点的现象是:锥形瓶中溶液_________________________。
(5)下列操作会引起实验结果偏大的是:______(填编号)
A.滴定终点时,有一滴标准液悬挂在滴定管尖嘴处
B.观察计数时,滴定前俯视,滴定后仰视
C.锥形瓶先用蒸馏水洗涤后,未用待测液润洗
D.用酸式滴定管量取液体时,释放液体前滴定管前端有气泡,之后消失
E.滴定时振荡锥形瓶有溶液飞溅出去
F.配制标准NaOH溶液定容时仰视观察刻度线
Ⅱ.(6)为了检验某残留物中铁元素的含量,先将残留物预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,写出滴定过程中反应的离子方程式:________________________________________。KMnO4应装在___________滴定管中(填“酸式”或“碱式”)滴定前是否要滴加指示剂?___(填“是”或“否”),滴定终点的判断方法:_____________________________。
(7)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入______________调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________________。[Fe(OH)3的Ksp=2.6×10-39]
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取氧气的反应:2H2O2=2H2O+O2↑下列条件下,反应的速率最快的是( )
选项 | H2O2的质量分数 | 温度 | 催化剂 |
A | 5% | 5℃ | MnO2 |
B | 5% | 40℃ | MnO2 |
C | 10% | 5℃ | 无 |
D | 10% | 40℃ | MnO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】水的电离平衡曲线如图所示。
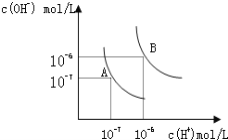
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从_____________增加到_____________。
(2)保持100℃的恒温,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为____________________。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈________(填“酸性”,“中性”或“碱性”),醋酸体积____________氢氧化钠溶液体积。(填“ >” 或“=”或“<” )。
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,上述离子浓度大小关系中正确的是(选填字母)________。
②若上述关系中D是正确的,则溶液中的溶质为____________________;
③若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)= _____
查看答案和解析>>
科目: 来源: 题型:
【题目】大气与生态圈的氮循环如图所示,下列叙述不正确的是

A. ④维持大气中氮元素含量稳定
B. ①是野生植物生长所需氮元素的重要来源
C. ⑤为硝化过程、④为反硝化过程,都是氮元素的还原反应过程
D. ②是氮肥工业基础,科学家努力将固氮变化条件趋近生物固氮
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com