
科目: 来源: 题型:
【题目】“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体,CO2的综合利用是解决温室及能源问题的有效途径。
(1)CO2催化加氢能合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)。不同温度下平衡时的四种气态物质的物质的量如图所示,则曲线b表示的物质为________(填化学式)。
C2H4(g)+4H2O(g)。不同温度下平衡时的四种气态物质的物质的量如图所示,则曲线b表示的物质为________(填化学式)。

(2)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应A:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应B:CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图所示。

①由图可知温度升高CO的产率上升,其主要原因可能是_____。
②由图可知获取CH3OH最适宜的温度是________,下列措施有利于提高CO2转化为CH3OH的平衡转化率的有________(填字母)。
A. 使用催化剂
B. 增大体系压强
C. 增大CO2和H2的初始投料比
D. 投料比和容器体积不变,增加反应物的浓度
(3)在恒温恒容条件下,反应A达到平衡的标志有_____
A. 容器中气体压强不再发生变化
B. 容器中气体密度不再发生变化
C. 容器中气体颜色不再发生变化
D. 容器中气体平均摩尔质量不再发生变化
(4)由CO2制取C的太阳能工艺如图所示。“热分解系统”发生的反应为2Fe3O4![]() 6FeO+O2↑,每分解1 mol Fe3O4转移电子的物质的量为_____;“重整系统”发生反应的化学方程式为___。
6FeO+O2↑,每分解1 mol Fe3O4转移电子的物质的量为_____;“重整系统”发生反应的化学方程式为___。

查看答案和解析>>
科目: 来源: 题型:
【题目】今年是俄罗斯化学家门捷列夫提出“元素周期律”150周年。门捷列夫为好几种当时尚未发现的元素![]() 如“类铝”、“类硅”和“类硼”
如“类铝”、“类硅”和“类硼”![]() 留下了空位。而法国科学家在1875年研究闪锌矿(ZnS)时发现的“镓”,正是门捷列夫预言的“类铝”,性质也是和预言中惊人的相似。
留下了空位。而法国科学家在1875年研究闪锌矿(ZnS)时发现的“镓”,正是门捷列夫预言的“类铝”,性质也是和预言中惊人的相似。
回答下列问题:

(1)①写出镓的基态原子的电子排布式______;门捷列夫预言的“类硼”就是现在的钪、“类硅”即使现在的锗,这三种元素的原子中,未成对的电子数最多的是______![]() 填元素符号
填元素符号![]() 。
。
②下列说法最有可能正确的一项是______。![]() 填字母
填字母![]()
A.类铝在![]() 时蒸气压很高
时蒸气压很高 ![]() 类铝的氧化物不能溶于碱
类铝的氧化物不能溶于碱
C.类铝不能与沸水反应 ![]() 类铝能生成类似明矾的矾类
类铝能生成类似明矾的矾类
![]() 氯化镓熔点77.9℃,其中镓的杂化方式与下列微粒的中心原子杂化方式相同且氯化镓空间构型也与其微粒相同的是______。
氯化镓熔点77.9℃,其中镓的杂化方式与下列微粒的中心原子杂化方式相同且氯化镓空间构型也与其微粒相同的是______。![]() 填字母
填字母![]()
A.PCl3B.SO3C.CH3-D.NO3-
(3)镓多伴生在铝土矿、二硫镓铜矿等矿中。
①Cu(OH)2可溶于氨水,形成的配合物中,配离子的结构可用示意图表示为![]() 用“
用“![]() ”表示出配位键
”表示出配位键![]() ______。
______。
②锌的第一电离能(I1)大于铜的第一电离能,而锌的第二电离能(I2)却小于铜的第二电离能的主要原因是______。
(4)2011年,我国将镓列为战略储备金属,我国的镓储量约占世界储量的80%以上。砷化镓也是半导体材料,其结构与硫化锌类似,其晶胞结构如图所示:
①原子坐标参数是晶胞的基本要素之一,表示晶胞内部各原子的相对位置。图中A(0,0,0)、![]() 、
、![]() ,则此晶胞中,距离A球最远的黑球的坐标参数为______。
,则此晶胞中,距离A球最远的黑球的坐标参数为______。
![]() 若砷和镓的原子半径分别为acm和bcm,砷化镓的摩尔质量Mg/mol为、密度为ρg/cm3,晶胞中原子体积占空间体积百分率为w即原子体积的空间占有率
若砷和镓的原子半径分别为acm和bcm,砷化镓的摩尔质量Mg/mol为、密度为ρg/cm3,晶胞中原子体积占空间体积百分率为w即原子体积的空间占有率![]() ,则阿伏加德罗常数为______mol-1。
,则阿伏加德罗常数为______mol-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空
(1)铁屑加入硝酸银溶液中反应的离子方程式为______。
(2)醋酸(CH3COOH)与烧碱溶液反应的离子方程式为______。
(3)NaHSO4是一种______(填“酸、碱、盐”),向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性时,该反应的离子方程式为_____。
(4)实验室制备少量Fe(OH)3胶体的化学方程式为______。
(5)配平下列方程式:____SO32-+___IO3-+___H+=___SO42-+___I2+___H2O,______
(6)一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O,从而可知在RO3n-中,元素R的化合价是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】羰基硫(COS)与氢气或与水在催化剂作用下的反应如下:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △H1=-17kJ/mol;
H2S(g)+CO(g) △H1=-17kJ/mol;
Ⅱ.COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2=-35kJ/mol。
H2S(g)+CO2(g) △H2=-35kJ/mol。
回答下列问题:
(1)两个反应在热力学上趋势均不大,其原因是:________________。
(2)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的△H=_______。
H2(g)+CO2(g)的△H=_______。
(3)羰基硫、氢气、水蒸气共混体系初始投料比不变,提高羰基硫与水蒸气反应的选择性的关键因素是______。
(4)在充有催化剂的恒压密闭容器中只进行反应Ⅰ![]() 设起始充入的n(H2):n(COS)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示:
设起始充入的n(H2):n(COS)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示:

①m1______m2(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
②温度高于T0,COS转化率减小的可能原因为:i有副应发生;ii______;iii______。
(5)在充有催化剂的恒压密闭容器中进行反应Ⅱ.COS(g)与H2O(g)投料比分别为1:3和1:1,反应物的总物质的量相同时,COS(g)的平衡转化率与温度的关系曲线如图所示:
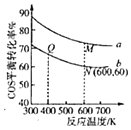
①M点对应的平衡常数______Q点![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;
;
②N点对应的平衡混合气中COS(g)物质的量分数为______;
③M点和Q点对应的平衡混合气体的总物质的量之比为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA代表阿伏伽德罗常数的数值,下列说法正确的是( )
A. 48gO2和O3的混合气体所含原子数为3NA
B. 标准状况下,22.4L氮气含有的核外电子数为28NA
C. 5.6g铁与足量稀盐酸反应转移的电子数为0.3NA
D. 20g49%的硫酸中,H2SO4分子数为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】A—J都是初中化学常用的物质。其中B、E、H、J是单质,其余均为化合物,气体C可用于灭火。它们相互间的转化关系如下图所示(部分反应物、生成物及反应条件已略去)。

请回答下列问题:
⑴写出物质D、J的化学式:D___________,J___________。
⑵“气体C→B”的转化过程,在自然界中称为____________作用。
⑶反应①的反应条件___________,其基本反应类型___________。
⑷写出反应②的化学方程式:______________________。
⑸若要实现“H+I→红色固体J”的转化,物质I必须满足的条件是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应是放热反应,但不是氧化还原反应的是( )
A. 铝片与稀硫酸的反应B. 氢氧化钡与硫酸的反应
C. 灼热的炭与二氧化碳的反应D. 甲烷在氧气中燃烧
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产生活、能源开发、环境保护、资源利用等密切相关。下列叙述错误的是
A.煤的气化、液化、干馏和石油的裂化、裂解都是化学变化
B.淀粉、纤维素和油脂都属于天然高分子化合物
C.“火树银花”焰火的实质是某些金属元素的焰色反应
D.合成纤维和光导纤维都是新型无机非金属材料
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
①称取w g草酸晶体,配成100.00mL水溶液。
②量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀硫酸。
③用浓度为a mol·L1的KMnO4溶液滴定到滴入最后一滴KMnO4半分钟后不再褪色为止。
所发生反应:KMnO4+H2C2O4+H2SO4——K2SO4+CO2↑+MnSO4+H2O(未配平)。
试回答:
(1)实验中不需要的仪器有_____(填序号),还缺少的仪器有_____。
a.托盘天平(带砝码,镊子);b.滴定管;c.100 mL量筒;d.滴定管夹;e.烧杯;f.漏斗;g.锥形瓶;h.玻璃棒;i.药匙;f铁架台。
(2)实验中,标准液KMnO4溶液应装在_________式滴定管中。
(3)误差讨论:
①若滴定终点时俯视滴定管刻度,则由此测得的x值会_____(填“偏大”“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会_____。
(4)在滴定过程中若用a mol·L1的KMnO4溶液V mL,则所配制的草酸溶液的物质的量浓度为_________mol·L1,由此可计算x值是_________。(用代数式表达)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com