
科目: 来源: 题型:
【题目】如图所示a、b都是惰性电极,通电一段时间后,a极附近溶液显红色。下列说法中正确的是( )
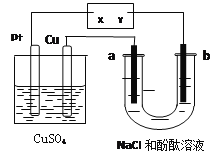
A. X是正极,Y是负极 B. U型管中溶液PH值逐渐变小
C. CuSO4溶液的pH逐渐减小 D. CuSO4溶液的pH保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ·mol-1, 则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为
A. +184.6kJ·mol-1B. -92.3kJ·mol-1
C. -369.2kJ·mol-1D. +92.3kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为_____ mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。该学生需要量取___mL上述浓盐酸进行配制。
(4)①假设该同学成功配制 了0.400 mol/L的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取____ mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是_____。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目: 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如下:

流程中相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(1) 为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:
①适当升高温度;②搅拌;③________等。
(2) 加入H2O2时发生主要反应的离子方程式为________________。
(3) “除铁”时,控制溶液pH的范围为______________。
(4) 滤渣B的主要成分的化学式为______________。
(5) 已知:Ksp(NiCO3)=1.42×10-7。为确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),应保持溶液中c(CO32-)>________mol·L-1。
(6) “氧化”生成Ni2O3的离子方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锂亚硫酰氯(Li/SOCl2)电池是实际应用电池系列中比能量最高的一种电池,剖视图如图所示,一种非水的LiAlCl4的SOCl2溶液为电解液。亚硫酸氯既是电解质,又是正极活性物质,其中碳电极区的电极反应式为2SOCl2+4e-=4Cl-+S+SO2↑,该电池工作时,下列说法错误的是( )

A. 锂电极区发生的电极反应:Li-e-=Li+
B. 放电时发生的总反应:4Li+2SOCl2=4LiCl+SO2↑+S
C. 锂电极上的电势比碳电极上的低
D. 若采用水溶液代替SOCl2溶液,电池总反应和效率均不变
查看答案和解析>>
科目: 来源: 题型:
【题目】螺环化合物具有抗菌活性,用其制成的药物不易产生抗药性,螺[3,4]辛烷的结构如图,下列有关螺[3,4]辛烷的说法正确的是( )

A. 分子式为C8H16B. 分子中所有碳原子共平面
C. 与2—甲基—3—庚烯互为同分异构体D. 一氯代物有4种结构
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上采用氯化铵熔烧菱锰矿制备高纯碳酸锰的流程如图所示:

已知:①菱锰矿的主要成分是MnCO3,其余为Fe、Ca、Mg、Al等元素。②部分阳离子沉淀时溶液的pH;
离子 | Al3+ | Fe3+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 4.1 | 2.2 | 10.6 | 8.1 | 9.1 |
沉淀完全的pH | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
③焙烧过程中主要反应为MnCO3+2NH4C1![]() MCl2+2NH3↑+CO2↑+H2O
MCl2+2NH3↑+CO2↑+H2O
(1)合1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、c(NH4C1)/c(菱锰矿粉)分别为______、______、______。

(2)对浸出液净化除杂时,需先加入MnO2,作用是______,再调节溶液pH的最大范围为______,将Fe3+和Al3+变为沉淀面除去,然后加人NH4F将Ca2+、Mg2+变为氧化物沉淀除去。
(3)”碳化结品”步骤中,加入碳酸氢铵时反应的离子方程式为______。
(4)上述流程中可循环使用的物质是______(填化学式)。
(5)现用滴定法测定产品中锰的含量。实验步骤:称取4.000g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnO2完全转化为[Mn(PO4)2]3-(其中NO3-转化为NO2-);加入稍过量的硫酸,发生反应NO2-+NH4+=N2↑+2H2O以除去NO2-;加入稀硫酸酸化,再加入60.00mL0.500molL-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-;用5.00mL0.500molL-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为______。
②试样中锰的质量分数为______。
查看答案和解析>>
科目: 来源: 题型:
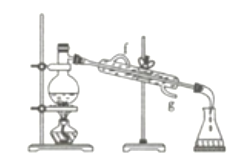
【题目】实验是化学研究的一种重要手段,现有如图所示A~E五种仪器,请根据要求填空。

(1)写出仪器名称:C__________,E_________。
(2)下列实验操作中用到仪器E的是___________(填字母)。
a.分离水和CCl4的混合物
b.分离水和酒精的混合物
c.分离水和泥沙的混合物
d.分离NaCl溶液中的NaCl和水
(3)仪器A~E中使用前必须检查是否漏水的是_________。
(4)若利用下图装置分离四氯化碳和酒精的混合物,则还缺少的仪器是____________,加热前应先在圆底烧瓶中加入几粒沸石,目的是_________________________;冷凝管的进水口是________(填“f”或“g”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向1L0.1mol/LNH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发)。下列说法不正确的是

A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入,  不断增大
不断增大
D. 当n(Na0H)=0.1mol时,c(Na+)=c(NH4+)+c(NH3·H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com