
科目: 来源: 题型:
【题目】某同学采用萃取-分液的方法从碘水中提取碘,主要操作步骤如下图:
①该同学所采用的萃取剂可能是______(填序号)。
A. 酒精 B. 苯 C. 四氯化碳 D. 汽油
甲. 加入草取剂后振荡 乙. 静置分层
乙. 静置分层 丙. 分离
丙. 分离
②甲、乙、丙3步实验操作中,不正确的是____________(填“甲”、“乙”或“丙”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铂钻合金是以铂为基含钻二元合金,在高温下,铂与钻可无限互溶,其固溶体为面心立方晶格。铂钻合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表电子钟表磁控管等。
(1)基态钴原子的价电子排布图为______。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体(如图)。科学研究表明,顺式分子具有抗癌活性。

①吡啶分子是大体积平面配体,其结构简式如图所示,每个分子中含有的σ键数目为______。二氯二吡啶合铂分子中所含的C、N、Cl三种元素的第一电离能由大到小的顺序是______。
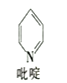
②二氯二吡啶合铂中存在的微粒间作用力有______(填字母)。
a.范德华力b.氢键c.金属键d非极性键
③反式二氯二吡啶合铂分子是______(填“极性分子”或“非极性分子”)。
(3)某研究小组将平面型的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属”,其结构如图所示。

①“分子金属”可以导电,是因为______能沿着其中的金属原子链流动。
②“分子金属”中,铂原子是否以sp3的方式杂化?______(填“是”或“否”),其理由是______。
(4)筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构(如图所示,小球表示Co原子,大球表示O原子),图中用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是______(填字母)。

(5)金属铂品体中,铂原子的配位数为12,其立方晶胞沿式x、y或z轴的投影图如图所示,若金属铂的密度为dgm-3,则晶胞参数a=______nm(列计算式)。

查看答案和解析>>
科目: 来源: 题型:
【题目】(1)2012年伦敦奥运会火炬采用丙烷为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:

①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为________。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol C2H5OH(g)=C2H5OH(l) ΔH=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3 kJ/mol
若使46 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为________kJ。
②碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应: C(s)+![]() O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是

A. 电解过程中,d电极质量增加 B. 电解过程中,氯离子浓度不变
C. a为负极,b为正极 D. a为阳极,b为阴极
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,能说明化学平衡一定向正反应方向移动的是( )
A. N2O4(g)![]() 2NO2(g),改变某一条件后,气体颜色加深
2NO2(g),改变某一条件后,气体颜色加深
B. H2(g)+I2(g)![]() 2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2
2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2
C. N2(g)+3H2(g) ![]() 2NH3(g),改变某一条件后,NH3的体积分数增加
2NH3(g),改变某一条件后,NH3的体积分数增加
D. 2SO2(g) +O2(g)![]() 2SO3(g),恒温恒压条件下,充入He
2SO3(g),恒温恒压条件下,充入He
查看答案和解析>>
科目: 来源: 题型:
【题目】将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
①用物质A表示的反应平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 78g Na2O2与足量SO2反应,转移电子数为NA
B. 标准状况下,11.2L的HF中含有 H—F键的数目为0.5NA
C. 100g CaS与CaSO4的混合物中含有32g硫,则含有的氧原子数为1.75NA
D. 一定温度下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含有NH4+的物质的量相同
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钛(Ti)硬度大、熔点高、耐酸碱腐蚀,被广泛用于航天航空、医疗卫生及日常生活中。以钛铁矿(主要成分是FeTiO3)为原料冶炼金属钛的生产工艺如下:

(1)钛铁矿(精矿)中加入硫酸,充分反应后生成TiOSO4、H2O和另外一种硫酸盐,且反应前后Fe的化合价不变,则FeTiO3中Fe的化合价为______。
(2)上述制备过程中,加入“铁屑”的目的是______(填字母)。
A.防Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解 D.防Fe3+水解
(3)上述生产流程中,灼烧操作需要用到的含硅酸盐的仪器有玻璃棒、酒精灯、____________。
(4)已知钛酸难溶于水,其化学式为H2TiO3。则加热溶液2时反应的离子方程式为______。
(5)已知气体丙是一种有毒气体,写出二氧化钛与氯气和过量焦炭在高温下反应的化学方程式______。
(6)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金性质时,往含有TiO2+、Fe3+的溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
① 2Fe3++Fe =3Fe2+
② Ti3+(紫色)+Fe3++H2O =TiO2+(无色)+Fe2++2H+
③______。
(7)以绿矾为原料,可以制备重要工业原料氧化铁。基本流程如下:
![]() FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5 mol/L。请通过计算判断所得FeCO3固体中是否混有Fe(OH)2_____(已知: Ksp[Fe(OH)2] = 4.9×10-17)
FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5 mol/L。请通过计算判断所得FeCO3固体中是否混有Fe(OH)2_____(已知: Ksp[Fe(OH)2] = 4.9×10-17)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 不同核素的质量数必定不同
B. 互为同位素的原子,其质子数必定相等
C. 32S、33S具有不同的电子数
D. 核外电子数相同的微粒必定属于同一种元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com