
科目: 来源: 题型:
【题目】将m1g铜铝合金投入到1 L含H2SO4和HNO3的混合溶液中,合金完全溶解后只生成VL —氧化氮气体(标准状况),向反应后的溶液中逐滴加入1mol/L NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如下图所示。下列说法中不正确的是:

A. 2c(H2SO4) + c(HNO3) = 0.8 mol·L-1
B. m2—m1=5.1
C. 原合金中铝的质量分数为34.7%
D. V = 2.24
查看答案和解析>>
科目: 来源: 题型:
【题目】美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如下图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成。 “纳米车”可以用来运输单个的有机分子。下列说法正确的是

A. 人们用肉眼可以清晰看到“纳米车”的运动
B. “纳米车”的诞生说明人类操纵分子的技术进入了一个新阶段
C. C60是一种新型的化合物
D. C60与金刚石互为同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
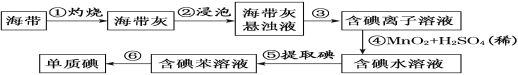
请回答下列问题:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是________(填标号)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是________。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是___________________。
在分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:________
查看答案和解析>>
科目: 来源: 题型:
【题目】我国对可呼吸的钠——二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2![]() 2Na2CO3+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中)。关于该电池,下列说法错误的是
2Na2CO3+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中)。关于该电池,下列说法错误的是

A. 放电时,当转移1 mol电子时负极质量减轻23 g
B. 充电时,Na+从阳极向阴极移动
C. 放电时,正极反应式为3CO2+4Na++4e-=2Na2CO3+C
D. 可以用乙醇代替TEGDME作有机溶剂
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ\(1)“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化剂及军事科学中。所谓“纳米材料”是指研究、开发出的微粒直径从几纳米到几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是 ____。
A.能全部透过滤纸 B.有丁达尔效应 C.所得液体呈胶状 D.所得物质一定是悬浊液
(2)把淀粉溶液溶于沸水中,制成淀粉胶体,鉴别溶液和淀粉胶体可以利用的方法是__________。
(3)把少量的FeCl3饱和溶液滴入沸水中,制成Fe(OH)3胶体后滴入少量稀硫酸可观察到的现象是:__,继续滴加至稀硫酸过量可观察到的现象是_____,写出上述反应的化学方程式____。
Ⅱ\给下图①~⑤选择适当的物质,使有连线的两物质能发生反应。供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉。

(1)请推断它们的化学式分别为:②______,③ ______,⑤_______。
(2)写出下列序号之间的化学方程式:①和②:_______________,②和④:____________,③和④:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A. 2.3gNa投入到97.7g水中形成溶液的质量分数为2.3%
B. 25g CuSO4.5H2O溶于水配成1L溶液,溶质的物质的量浓度为0.1mol/L
C. Na2O2溶于水后溶质未发生改变
D. 标准状况下,22.4 L的SO3中所含分子数为NA个
查看答案和解析>>
科目: 来源: 题型:
【题目】见下图(A)处通入Cl2,当关闭(B)阀时,(C)处的湿润的红布条没有明显变化,当打开(B)阀时,(C)处的湿润红布条逐渐褪色,则(D)瓶中装的溶液是

A. 浓硫酸B. NaOH溶液C. 水D. NaCl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)用单线桥标出①中电子转移的方向和数目_____;
(2)写出②的离子化学方程式____;
(3)Cl2、SO2和KMnO4的氧化性由强到弱的顺序为____;
(4)反应②中氯化氢表现出的性质是____。
a.还原性 b.酸性 c.氧化性
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)以上三种电解质由强至弱顺序为________________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为_____________,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>、<或=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为___________________________________________________。
(4)已知NaHSO3溶液显酸性,其原因是____________________(离子方程式配适当文字叙述)。
(5)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com