
科目: 来源: 题型:
【题目】重铬酸钠在制革工业、印刷工业、电镀工业等有重要用途,制备重铬酸钠(Na2Cr2O7)的方案1的流程图如图,铬铁矿的主要成分可表示为FeO·Cr2O3,还含有Al2O3、Fe2O3、SiO2等杂质。

除此外工厂还有相关改进工艺,制备重铬酸钠(Na2Cr2O7)的方案2如图,采用电化学原理如图所示的装置(电极为石墨),通过电解提高阳极区溶液的酸性,实现Na2CrO4转化为Na2Cr2O7。

(1)在方案2中请指明哪端是阴极? ___________(填“左”或“右”)。写出阳极的电极方程式:______________________。
(2)方案1中煅烧前应将铬铁矿充分粉碎,其目的是______________________。灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,下列各实验仪器中不需要的是___________(填序号)。
a.陶瓷坩埚 b.铁坩埚 c.三脚架 d.泥三角
转窑中发生的主要反应除了下面的两个反应外,还有其他反应。
①Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
②_____FeO·Cr2O3+______Na2CO3+______O2![]() ______Na2CrO4+______Fe2O3+______。
______Na2CrO4+______Fe2O3+______。
请配平反应②的化学方程式。
请写出其他主要反应方程式:_________________________________。
(3)固体Y的化学式为___________、___________。
(4)向母液中加入浓硫酸,把铬酸钠转化为重铬酸钠,经两次蒸发,主要是除去___________(填化学式),冷却至30-40℃得到产品晶体。洗涤该晶体的溶剂最好是___________(填序号)。
a.蒸馏水 b无水乙醇 c.75%乙醇溶液
(5)为了测定实验制得的产品中Na2Cr2O7,的含量,称取样品0.140g置于锥形瓶中,加50mL水;再加入2gKI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min;然后加入150mL蒸馏水并加入3mL0.5%淀粉溶液;用0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL。(假定杂质不参加反应,已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-===2I-+S2O62-)
①终点实验现象是_______________________________________________________。
②该产品中Na2Cr2O7的纯度为______________________。(以质量分数表示)
③若滴定管在滴定前俯视读数,滴定结束后仰视读数,测得样品的纯度将___________(填“偏高”或“偏低”或“无影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钛在航天、潜海和医疗方面应用广泛。工业上用钛铁矿(主要成分为钛酸亚铁FeTiO3,含FeO、Fe2O3、SiO2)为原料制TiO2,再由TiO2制得金属Ti

资料:TiO2+会发生水解
(1)步骤②、③、④中,均需用到的操作是_______。(填操作名称)
(2)检验滤液2中是否含Fe3+的方法是:_______。
(3)步骤1中FeTiO3溶于过量硫酸的化学方程式___________。

(4)请结合化学用语解释步骤④中加热水的原因___________。
(5)电解法获得Ti是通过图装置,以熔融CaCl2做电解质
①a为电源的_____(填“正”或“负”)
②在制备钛的过程中石墨电极附近的气泡中除了O2、CO、CO2外还可能有的气体是______________,用化学用语解释原因________________。
(6)测定废液中Fe2+浓度已确认铁元素的回收率:取25.00ml废液于锥形瓶中,用硫酸酸化的xmol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积如图所示:
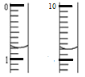
(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O).废液中c(Fe2+)=_________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)一定温度下有:a.盐酸 b.硫酸 c.醋酸三种酸溶液.(用序号abc填空)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是__________.
②当其pH相同时,物质的量浓度由大到小的顺序为_________.将其稀释10倍后,pH由大到小的顺序为_____________
(2)某温度下,纯水中的c (H+)= 4.0×10-7 mol/L, 则此温度下纯水中的c (OH-)=______________mol/L; 若温度不变, 滴入稀NaOH溶液, 使c (OH-)= 5.0×10-6 mol/L,则溶液的c (H+)= _________________mol/L.
(3)在25℃时,100ml 1.0mol/L的盐酸与等体积1.2mol/L的氢氧化钠溶液混合, 混合后溶液的pH= _______________
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为______mol·L-1。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器

B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为______mol·L-1。
②需用浓硫酸的体积为________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】煤气化和液化是现代能源工业中重点考虑的能源综合利用方案。最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH。
(1)已知:CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)===2CO2(g) ΔH2
2H2(g)+O2(g)===2H2O(g) ΔH3
则反应CO(g)+2H2(g)===CH3OH(g)的ΔH=______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
②由CO合成甲醇时,CO在250 ℃、300 ℃、350 ℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为________ ℃。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是____________。

③以下有关该反应的说法正确的是________(填序号)。
A.恒温、恒容条件下,若容器内的压强不再发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2 mol CO和6 mol H2充入2 L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为80%
(3)一定温度下,向2 L固定体积的密闭容器中加入1 mol CH3OH(g),发生反应:CH3OH(g) ![]() CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。

0~2 min内的平均反应速率v(CH3OH)=__________。该温度下,反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=__________。相同温度下,在一个恒容容器中加入一定量的CO(g)和H2发生:CO(g)+2H2(g)
CH3OH(g)的平衡常数K=__________。相同温度下,在一个恒容容器中加入一定量的CO(g)和H2发生:CO(g)+2H2(g) ![]() CH3OH(g)的反应,某时刻测得体系中各物质的量浓度如下:C(CO)=0.25 mol·L-1,C(H2)=1.0 mol·L-1,C(CH3OH)=0.75 mol·L-1,则此时该反应_____进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
CH3OH(g)的反应,某时刻测得体系中各物质的量浓度如下:C(CO)=0.25 mol·L-1,C(H2)=1.0 mol·L-1,C(CH3OH)=0.75 mol·L-1,则此时该反应_____进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究。
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:

①装置D的名称为___________。
②按照气流从左到右的方向,上述装置的连接顺序为___________→尾气处理装置(填仪器接口的字母编号)。
③实验前先通入一段时间N2,其目的为______________________。
④实验证明了气体产物中含有CO,依据的实验现象为______________________。
(2)固体产物成分的探究。充分反应后,A处反应管中残留黑色固体。查阅资料可知,黑色固体可能为Fe或FeO。小组成员设计实验证明了其成分只有FeO,其操作及现象为___________。
(3)依据(1)和(2)结论,可知A处反应管中发生反应的化学方程式为___________。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取m g草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液。
步骤2:取上述溶液25.00mL,用c mol· L -1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤3中加入锌粉的目的为____________________________________________。
(5)草酸亚铁晶体样品的纯度为____________________________________________;若步骤1配制溶液时部分Fe2+被氧化,则测定结果将___________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可用氯气与一氧化氮在常温常压条件下合成亚硝酰氯(NOCl)。已知亚硝酰氯是一种黄色气体,熔点:-64.5℃,沸点:-5.5℃,遇水易反应生成一种无氧酸和两种氮的常见氧化物
(1)甲组同学拟制备原料气NO和Cl2制备装置如图所示

①为制备并得到纯净干燥的气体,补充下表中缺少的药品。
装置I中药品 | 装置II中药品 | ||
蒸馏烧瓶 | a仪器 | ||
制备纯净Cl2 | KmnO4 | 浓盐酸 | (i)___________ |
制备纯净的NO | Cu | (ii)__________ | 水 |
②仪器a的名称为____;装置Ⅲ的作用是______________。
(2)乙组同学对甲组同学制取NO的装置略加改良,利用甲组制得的Cl2共同制备NOCl,装置如下图所示

①组装好实验装置,检查气密性,依次装入药品。此实验关健操作有两点:I将Cl2充满D装置的三颈瓶;Ⅱ,A中反应开始时,先关闭K2,打开K1,待NO充满装置后关闭K1,打开K2。这两步操作都要“充满”,目的是__________。
②装置B中水的作用是___________________(用化学方程式表示)。
③若装置C中压强过大,可以观察到的现象是________________。
④装置D中冰盐水的作用是___________________________。
⑤如果去掉盛有浓硫酸的C、装有无水CaCl2的E两装置,对该实验的主要影响是________(用化学方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应进行到一定程度时,反应物、生成物浓度均不再改变这是因为
A. 反应停止了B. 某种反应物已完全反应
C. 正反应速率和逆反应速率相等D. 反应物和生成物的物质的量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)除去自来水中的Ca2+、Mg2+、Cl—、SO42—等杂质,选择装置_____________(填代表装置图的字母)。
(2)用CCl4萃取碘水中的I2,有机层的颜色为___________________。
(3)装置A中①的名称是_____________,进水的方向是_____________。装置B在分液时为使液体顺利滴下,应进行的具体操作是_____________。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:

问题1:粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。
正确的操作顺序是_____________(填写字母)。
a.⑤②③①⑥④⑦b.⑤①②③⑥④⑦ c.⑤③②①⑥④⑦d.⑤②①③④⑥⑦
问题2:由海水到氯化钠晶体的实验过程中要用到的主要装置是_____________(从给定的四种装置中选择,填字母)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物M可用于消毒剂、抗氧化剂、医药中间体。实验室由芳香烃A制备M的一种合成路线如下:

请回答:
(1)B的化学名称为___________;D中官能团的名称为______________________。
(2)由F生成G的反应类型为___________;F的分子式为___________。
(3)由E转化为F的第一步反应的化学方程式为______________________。
(4)M的结构简式为___________。
(5)芳香化合物Q为C的同分异构体,Q能发生银镜反应,其核磁共振氢谱有4组吸收峰。写出符合要求的Q的一种结构简式______________________。
(6)参照上述合成路线和信息,以苯甲酸乙酯和CH3MgBr为原料(无机试剂任选),设计制备 的合成路线_________________________________。
的合成路线_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com