
科目: 来源: 题型:
【题目】氯化亚铜广泛应用于有机合成、石油、油脂、染料等工业。以某种铜矿粉(含Cu2S、CuS及FeS等)为原料制取CuCl的工艺流程如下:
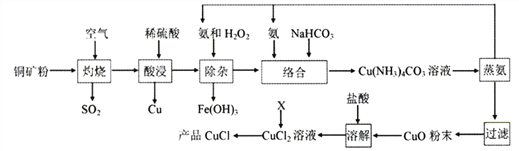
已知:①CuS、Cu2S、FeS灼烧固体产物为Cu2O、FeO;
②Ksp(CuCl)=2×10-7,2Cu+=Cu+Cu2+的平衡常数K1=1×106
回答下列问题:
(1)“灼烧”时,被还原的元素有____________(填元素符号)。
(2)“酸浸”所需H2SO4是用等体积的98%H2SO4和水混合而成。实验室配制该硫酸溶液所需的玻璃仪器除玻璃棒、胶头滴管外,还有_______。“酸浸”时硫酸不宜过多的原因是__________________。
(3)“除杂”的总反应方程式是_____________________。
(4)“络合”反应中的NH3与NaHCO3理论比值是____________________。
(5)加热“蒸氨”在减压条件下进行的原因是________________。
(6)X可以充分利用流程中的产物,若X是SO2时,通入CuCl2溶液中反应的离子方程式是________________;若X是Cu时,反应Cu+Cu2++2Cl-=2CuCl的平衡常数K2=_________。
(7)以铜为阳极电解NaCl溶液也可得到CuCl,写出阳极电极反应式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,将1mol的CO和1mol水蒸气通入容器中发生下述反应:
CO+H2O![]() CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
A. 等于0.6mol B. 等于1mol
C. 大于0.6mol且小于1mol D. 大于1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO2常用来漂白织物,其漂白能力是漂白粉的4~5倍NaClO2也是一种重要的杀菌消毒剂。工业上生产NaClO2的一种工艺流程如下图所示:

(1)ClO2发生器中的产品之一是NaHSO4,在该发生器中所发生反应的离子方程式为___________。
(2)反应结束后,向ClO2发生器中通入一定量空气,目的是___________。
(3)吸收器中发生反应的化学方程式为___________。吸收器中要用冷的NaOH溶液和H2O2溶液吸收CO2,原因是___________。
(4)将ClO2通入食盐水中,用情性电极电解,也可以制得NaClO2产品。阳极的电解产物是___________(填化学式),阴极的电极反应式为___________。
(5)相同条件下,1 mol NaClO2与___________gCl2的氧化能力相当。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在标准状况下,由CO和CO2组成的混合气体为6.72L,质量为10g,此混合物中CO和CO2物质的量之比是___,CO的体积是___,C和O原子个数比是___。
(2)将MgCl2·xH2O的晶体4.06g溶于水配成100mL溶液,取出50mL溶液正好与0.02moL的AgNO3溶液完全作用。由上述数据计算:
①4.06g的MgCl2·xH2O物质的量____。
②式中x的数值____。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①2SO2(g)+O2(g)=2SO3(g)ΔH=-196.6 kJ·mol-1,②2NO(g)+O2(g)===2NO2(g) ΔH=-113.0 kJ·mol-1。下列热化学方程式正确的是
A. NO2(g)+SO2(g) ![]() SO3(s)+NO(g) ΔH=-41.8 kJ·mol-1
SO3(s)+NO(g) ΔH=-41.8 kJ·mol-1
B. SO3(g)+NO(g) ![]() NO2(g)+SO2(g) ΔH=+41.8 kJ·mol-1
NO2(g)+SO2(g) ΔH=+41.8 kJ·mol-1
C. NO2(g)+SO2(g) ![]() SO3(g)+NO(g) ΔH=-77.4 kJ·mol-1
SO3(g)+NO(g) ΔH=-77.4 kJ·mol-1
D. NO2(g)+SO2(g) ![]() SO3(g)+NO(g) ΔH=-183.6 kJ·mol-1
SO3(g)+NO(g) ΔH=-183.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)钙原子的结构示意图为_____。
(2)氧离子电子式为_____。
(3)0℃,1atm时,CO2的气体摩尔体积约为_____L/mol。
(4)1个普通水分子的质量大约是_____g。
(5)常温下,水的摩尔体积约为_____cm3/mol。
(6)已知n个12C原子的质量是a克,则m个32S原子的质量约是_____。
(7)电解饱和食盐水的方程式为_____;工业制漂白粉的方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:在300 K时,A(g)+B(g) ![]() 2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是
2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是
①C的生成速率与C的消耗速率相等 ②单位时间内生成a mol A,同时消耗2a mol C ③A、B、C的浓度不再变化 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的密度不再变化 ⑦A、B、C的分子数之比为1∶1∶2
A. ②⑤ B. ④⑦ C. ②③ D. ④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】化学平衡原理在工农业生产中发挥着重要的指导作用。
(1)反应C(s)+CO2(g) ![]() 2CO(g)平衡常数K的表达式为________________;
2CO(g)平衡常数K的表达式为________________;
已知C(s) + H2O(g)![]() CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)
CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g) ![]() CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为________________________。
CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为________________________。
(2)已知某温度下,反应2SO2+O22SO3,的平衡常数K=19
在该温度下的体积固定的密闭容器中,c0(SO2)=1mol·L-1,c0(O2)=1 mol·L-1,当反应在该温度下SO2转化率为80%时,该反应__________(填“是”或“否”)达到化学平衡状态,若未达到,向_________(填“正反应”或“逆反应”) 方向进行。
(3)对于可逆反应:aA(g) +bB(g) ![]() cC(g)+dD(g) △H = a kJ·mol-1;若a+b>c+d,减小压强平衡向_______(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a_______0(填“>”或“<”)
cC(g)+dD(g) △H = a kJ·mol-1;若a+b>c+d,减小压强平衡向_______(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a_______0(填“>”或“<”)
查看答案和解析>>
科目: 来源: 题型:
【题目】I.用于提纯或分离物质的方法有:A.萃取 B.冷却结晶 C.蒸发结晶 D.分液 E.蒸馏 F.过滤 G.加热等,请将提纯或分离的序号填在后面横线上。
(1)分离氯化钠固体和碘固体的混合物____。
(2)从含少量KCl的KNO3溶液中提取KNO3___。
II.通过蒸馏除去自来水中含有的氯离子等杂质制取纯净水,如图所示:
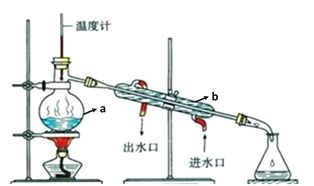
(1)写出下列仪器的名称:a____b_____
(2)仪器a中常加入少量___,这样做的目的是____。
(3)在进行实验操作前,应先___(a.点燃酒精灯;b.通冷凝水)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com