
科目: 来源: 题型:
【题目】SO2在生产、生活中有着广泛的用途。
(1)请你列举一个SO2在生活中的用途:______________________。
(2)SO2在工业上常用于硫酸生产:2SO2(g)+O2(g)![]() 2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为__________________。
2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为__________________。
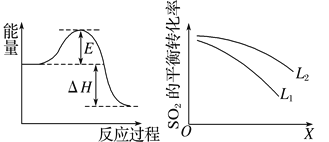
(3)上图中L、X表示物理量温度或压强,依据题中信息可判断:
①X表示的物理量是_________________________,
②L1________(填“>”“<”或“=”)L2。
(4)在容积固定的密闭容器中,起始时充入0.2molSO2和0.1molO2,反应体系起始总压强为0.1MPa。反应在一定的温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极的电极反应式:__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示。下列判断正确的是

A.溶液酸性越强,R 的降解速率越小
B.R的起始浓度越小,降解速率越大[
C.在0~50 min之间,pH=2和PH=7时R的降解百分率相等
D.在20~25 min之间,pH=10 时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】把镁条直接投入到盛有盐酸的敞口容器中,产生H2的速率如图所示,

在下列因素中,影响反应速率的因素是
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A. ①④B. ③④C. ①②③D. ②③
查看答案和解析>>
科目: 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:

已知:乙酸酐的结构简式为![]() 。
。
请回答下列问题:
(1)A的名称是______;B中所含官能团的名称是______。
(2)反应⑤的化学方程式为______,该反应的反应类型是______。
(3)G的分子式为______。
(4)写出满足下列条件的E的同分异构体的结构简式:______、______。
Ⅰ.苯环上只有三个取代基
Ⅱ核磁共振氢谱图中只有4组吸收峰
Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备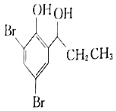 的合成路线流程图(无机试剂任选)______,合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任选)______,合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目: 来源: 题型:
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钴可无限互溶,其固溶体为面心立方晶格。铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。
(1)基态钴原子的价电子排布图为___________。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体(如下图)。科学研究表明,顺式分子具有抗癌活性。

①吡啶分子是大体积平面配体,其结构简式如图所示![]() 。每个吡啶分子中含有的σ键数目为___________。吡啶分子中所含的各元素的电负性由大到小的顺序是___________。
。每个吡啶分子中含有的σ键数目为___________。吡啶分子中所含的各元素的电负性由大到小的顺序是___________。
②二氯二吡啶合铂中存在的微粒间作用力有___________(填字母)。
a.范德华力 b.氢键 c.金属键 d.非极性键
③反式二氯二吡啶合铂分子是___________(填“极性分子”或“非极性分子”)。

(3)某研究小组将平面型的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属”,其结构如下图所示。
①“分子金属”可以导电,是因为___________能沿着其中的金属原子链流动。

②“分子金属”中,铂原子是否以sp3的方式杂化?_________(填“是”或“否”),其理由是_______。
(4)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿x、y或z轴的投影图如图所示。若金属铂的密度为dg·cm-3,则晶胞参数a=______nm(列计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌是一种常用金属,冶炼方法有火法和湿法。回答下列问题:
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
(1)Ga在元素周期表中的位置为___________。
(2)下列有关镓和镓的化合物的说法正确的是___________(填字母)。
A一定条件下,Ga可溶于盐酸和氢氧化钠溶液
B常温下,Ga可与水剧烈反应放出氢气
C.Ga2O3可由Ga(OH)3受热分解得到
D一定条件下,Ga2O3可与NaOH反应生成盐
Ⅱ工业上利用锌熔砂(主要含ZnO、ZnFe2O4,还含有少量 CaO, FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:
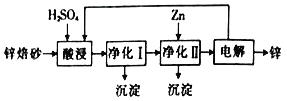
已知:Fe的活泼性强于Ni。
(3) ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式:___________。
(4)净化Ⅰ工操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,仅使Fe3+转化为Fe(OH)3沉淀,净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是______________________。
(5)净化Ⅱ中加入Zn的目的是______________________。
Ⅲ.(6)某化学课外小组拟用废旧电池锌皮(含杂质铁),结合如图所示信息,从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。
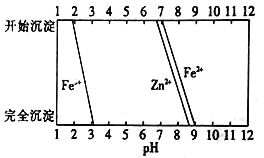
实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1的稀硫酸,加入___________(填字母,下同);
A.30%H2O2 B新制氯水 C.FeCl3溶液 D.KSCN溶液
②加入___________;
A纯锌粉 B纯碳酸钙粉末 C.纯ZnO粉末 D.3mol·L-1的稀硫酸
③加热到60℃左右并不断搅拌;
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知热化学方程式SO2(g)+1/2O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量
A. 等于196.64kJ B. 等于196.64kJ·mol-1
C. 小于196.64kJ D. 大于196.64kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.

(1)指出图中明显的错误________________;________________;
(2)A仪器的名称是________________;B仪器的名称是________________;
(3)萃取、分液实验中所用主要玻璃仪器的名称是________________,静置后分液的第一步操作是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的名称为__________________________;五种元素的原子半径从大到小的顺序为______________________________(用元素符号表示)。
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,工业合成A的化学方程式为______________________________,B的结构式为_____________________。在标准状况下,将A充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面上升,(假设溶质不扩散)最后烧瓶内溶液中溶质的物质的量浓度为________(精确到0.001)。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则其最高价氧化物对应水化物的化学式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向25.00mL 0.1mol·L-1 HSCN溶液中滴入0.1 mol·L-1 NaOH溶液,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加NaOH溶液体积的关系如图所示,下列说法正确的是

A. 常温下,Ka(HSCN)约为1×10-3
B. b=25.00
C. R、Q两点溶液对应的pH=7
D. N点溶液中:c(Na+)<c(SCN-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com