
科目: 来源: 题型:
【题目】反应3Fe(s)+4H2O(g) ![]() Fe3O4 (s)+4H2(g) ,在一个可变容积的密闭容器中进行,试回答:
Fe3O4 (s)+4H2(g) ,在一个可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率的变化是__________(填“增大”“不变”或“减小”,以下相同)。
(2)将容器的体积缩小一半,其正反应速率__________,逆反应速率__________。
(3)保持体积不变,充入N2 使体系压强增大,其正反应速率__________,逆反应速率__________。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率__________,逆反应速率__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)广州亚运会“潮流”火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”_____。

②写出表示丙烷燃烧热的热化学方程式:___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1835 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为_______。
(2)科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。
①P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(s,红磷)+5/4O2(g)===1/4P4O10(s) ΔH2=-738.5 kJ·mol-1
则白磷转化为红磷的热化学方程式为_________________________________________。相同的状况下,能量较低的是________;白磷的稳定性比红磷________(填“高”或“低”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质在一定条件下反应,可以制得较纯净的1,2—二氯乙烷的是( )
A. 乙烷与氯气光照反应B. 乙烯与氯化氢气体混合
C. 乙烯通入浓盐酸D. 乙烯与氯气混合
查看答案和解析>>
科目: 来源: 题型:
【题目】将24.4gNaOH固体溶于水配成100 mL溶液,其密度为1.219g/mL。
(1)该溶液中NaOH的物质的量浓度为____。
(2)该溶液中 NaOH的质量分数为___。
(3)从该溶液中取出10mL,其中NaOH的物质的量浓度为____,NaOH的质量分数为____,含NaOH的质量为___,含NaOH的物质的量为___。
(4)将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】含氮化合物在化学工业中有着重要的应用,回答下列问题:
(1)由N2O和NO反应生成N2和NO2的能量变化(表示生成1molN2的能量变化)如图所示,该反应的热化学方程式为______________________。

(2)一定条件下,硝酸铵加热分解得到的产物只有N2O和H2O。250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的平衡常数表达式为K=___________;若有1mol硝酸铵完全分解,则转移电子的数目为___________(设NA为阿伏加德罗常数的值)。
(3)硝基苯甲酸乙酯在碱性条件下发生反应:O2NC6H4COOC2H5+OH-![]() O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
t/s | 0 | 60 | 90 | 120 | 160 | 260 | 300 | 360 | 400 |
a/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
①该反应在60~90s与90~120s内的平均反应速率分别约为___________,___________;比较两者大小可得出的结论是______________________。
②计算T℃时该反应的平衡常数为______________________。
③为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施为______________________(写出一条即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应在常温下均为非自发反应,在高温下仍为非自发的是
A. 2Ag2O(s)=4Ag(s)+O2(g)
B. 2Fe2O3(s)+3C(s)=Fe(s)+3CO2(g)
C. N2O4(g)=2NO2(g)
D. 6C(s)+6H2O(l)=C6H12O6(s)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各关系式中能说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目: 来源: 题型:
【题目】TMB由碳氢氮三种元素组成,其相对分子质量为240,是一种新型指纹检测的色原试剂,已在逐步取代强致癌物联苯胺和其他致癌性的联苯胺衍生物应用于临床化验法医检验刑事侦破及环境监测等领域。某研究小组欲利用燃烧法测定TMB的分子式(氮元素转化为N2)实验装置如图所示。回答下列问题:
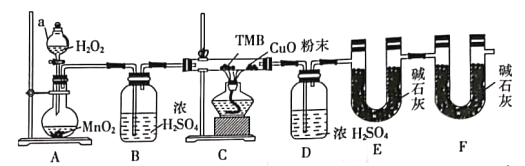
(1)实验装置两处用到装有碱石灰的干燥管,其中F处的目的是______________________。仪器a的名称是___________。
(2)将足量双氧水置于a中,圆底烧瓶中装入MnO2固体,按图连接好装置。
①A中发生反应的化学方程式为______________________。
②待B、D处导管口有均匀气泡时,再点燃C处酒精灯,原因是______________________。
(3)装置C中CuO粉末的作用为_________________________________。
(4)该实验___________(填“需要”或“不需要”)尾气处理,其原因是____________________。
(5)理想状态下,将4.80gTMB样品完全氧化,点燃C处酒精灯,实验结束时测得D增加3.60g,E增加14.08g,则TMB的分子式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g/cm3)配制100mL1.0mol·L-1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)需量取浓硫酸的体积为_______mL。
(2)实验时选用的仪器有(填序号)_______。
(3)配制过程中,下列情况会使配制结果偏高的是________(填序号) 。
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)_______。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4mol·L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com