
科目: 来源: 题型:
【题目】在一定温度下,10 mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
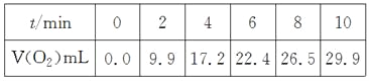
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平衡反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B. 6~10 min的平衡反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C. 反应到6 min时,c(H2O2)=0.30 mol·L-1
D. 反应到6 min时,H2O2分解了50%
查看答案和解析>>
科目: 来源: 题型:
【题目】CH4、CH3OH既是重要的化工原料,又是未来重要的能源物质。
(1)将1.0 mol CH4和2.0 mol H2O(g) 通入容积为2L的反应室,在一定条件下发生反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g),测得在5 min时达到平衡,CH4的平衡转化率为40%。则0~5 min内,用H2O表示该反应的平均反应速率为_________。
CO(g)+3H2(g),测得在5 min时达到平衡,CH4的平衡转化率为40%。则0~5 min内,用H2O表示该反应的平均反应速率为_________。
(2)一定条件下,将1.0 mol CH4与2.0 mol H2O(g)充入密闭容器中发生反应CH4(g)+H2O(g) ![]() CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是___________(填选项序号)。
CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是___________(填选项序号)。
a.恒容条件下充入He b.增大体积
c.升高温度 d.投入更多的H2O(g)
(3)在恒容条件下进行反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是___________(填选项序号)。
CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是___________(填选项序号)。
a.消耗1 mol CO2同时生成1 mol CH3OH b.容器内压强保持不变
c.混合气体的密度保持不变 d.CH3OH(g)的浓度保持不变
(4)以KOH为电解质的甲醇-空气燃料电池是一种高效、轻污染的车载电池,其工作原理如图。 回答下列问题:

①该原电池的正极是____(填“甲”或“乙”),电解过程中乙电极附近pH____(填“增大”或“减小”);
②负极的电极反应式________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出ClO2,ClO2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。

Ⅰ.制备亚氯酸钠
关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应。
(1)仪器a的名称为______________,仪器b的作用是______________。
(2)装置A中生成NaClO2的离子方程式为____________________________。
(3)若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有减压蒸发浓缩、_____、_____、洗涤、干燥等。
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因___________。
(5)B中现象为_________________ 。产生该现象的离子方程式为___________________。
(6)实验完成后,为防止装置中滞留的有毒气体污染空气,可以进行的操作是:再次打开止水夹①,__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼酸(H3BO3)为一元弱酸,广泛用于玻璃、医药、冶金、皮革等工业。回答下列问题:
(1) H3BO3中B元素的化合价为______,其在元素周期表的位置是_________________。
(2)已知:A(OH)3+H2O![]() [Al(OH)4]-+H+,H3BO3的电离方程式为_______。酸性:H3BO3 _____(填*>”或“<”)Al(OH)3。
[Al(OH)4]-+H+,H3BO3的电离方程式为_______。酸性:H3BO3 _____(填*>”或“<”)Al(OH)3。
(3) H3BO3受热分解得到的B2O3和镁粉混合点燃可得单质B,生成单质B的化学方程式为________。
(4) H3BO3可用于生产储氢材料NaBH4。涉及的主要反应为:
I.H3BO3+3CH3OH→B(OCH3)3+3H2O
II.B(OCH3)3+4NaH→NaBH4+3CH3ONa
①“反应I”的类型为__________(填标号)。
A.取代反应 B.加成反应 C.加聚反应 D.氧化反应
②NaH的电子式为_______________。
③在碱性条件下,NaBH4与CuSO4溶液反应可得Cu和Na[B(OH)4],其中H元素由-1价升高为+1价,该反应的离子方程式为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学方程式或离子方程式书写错误的是
A. 从海带中提取碘:H2O2 + 2I—+ 2H+ = 2H2O + I2
B. 乙烯使溴的四氯化碳溶液褪色:CH2=CH2+Br2→CH2Br—CH2Br
C. 苯与溴的反应:
D. 金属锂在空气中加热:2Li+O2 ![]() Li2O2
Li2O2
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以浓缩海水为原料提取溴的部分流程如右图:下列说法正确的是

A. 海水需要浓缩,是因为海水中的Br2含量较低
B. 热空气的作用是将多余的Cl2吹出
C. 吸收塔中发生的反应是3Br2+3CO32-=5Br-+BrO3-+3CO2↑
D. 反应釜2中发生的反应是5Br-+BrO3-+3H2O=3Br2+6OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤烟气的脱硫脱硝是目前研究的热点。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H= -574 kJmol-1
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H= -1160 kJmol-1
③H2O(g) = H2O(l) △H= -44 kJmol-1
则CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(l) △H=____________ kJ/mol
(2)某科研小组研究臭氧氧化--碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+ O3(g)= NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g) = SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
已知该体系中臭氧发生分解反应:2O3(g) ![]() 3O2(g)。请回答:
3O2(g)。请回答:
其它条件不变,每次向容积为2L的反应器中充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0 mol O3,改变温度,反应相同 时间t后体系中NO和SO2的转化率如图所示:

①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因___________________。
②下列说法正确的是________________。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
③假设100℃时P、Q均为平衡点,此时反应时间为10分钟,发生分解反应的臭氧占充入臭氧总量的10%,NO的平均反应速率为_____________;反应Ⅱ在此时的平衡常数为______________。
(3)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:

①M极发生的电极反应式为_____________________________。
②当外电路通过0.2 mol电子时,质子交换膜左侧的溶液质量__________(填“增大”或“减小”)、_________克。
查看答案和解析>>
科目: 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,被美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称为_______,E中官能团名称为________。
(2)B的结构简式为________。
(3)由C生成D的化学方程式为_________
(4)⑤的反应类型为______,⑧的反应类型为_________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应
其中核磁共振氢谱为五组峰的结构简式为_________。
(6)参照上述合成路线,设计一条由苯酚(![]() )、乙酸酐(CH3CO)2O和苯甲醛(
)、乙酸酐(CH3CO)2O和苯甲醛(![]() )为原料,制备
)为原料,制备 的合成路线(其他无机试剂任选)_____。
的合成路线(其他无机试剂任选)_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】以铁矿石(Fe2O3)为起始物,经过一系列反应可以得到Fe3[Fe(CN)6]2和Fe(SCN)3,请回答下列问题:
(1)写出Fe的原子结构示意图_____________,O原子核外电子轨道表示式为__________。
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为____________。SCN-的空间构型__________________
(3)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为________________,该化学键能够形成的原因是________________________________________________________________。
(4)K3[Fe(CN)5NO]的组成元素中,属于第2周期的元素的第一电离能由小到大的顺序是_________________,该配合物中铁原子的配位数是________________。
(5)FeO晶胞结构如图所示,FeO晶体中Fe2+配位数为________________,若该晶胞边长为anm,则该晶体密度为_________g·cm-3(阿伏伽德罗常数的值为NA)。

查看答案和解析>>
科目: 来源: 题型:
【题目】用标准NaOH溶液滴定充满HCl的烧瓶(标况下)做完喷泉实验后得到的稀盐酸,以测定它的准确浓度,请你回答下列问题:
(1)理论计算该盐酸的物质的量浓度为:________________________________。
(2)若用甲基橙作指示剂,达到满定终点时的现象是___________________________。
(3)现有三种浓度的标准NaOH溶液,你认为最合适的是下列第__________种。
①5.00mol·L-1 ②0.500mol·L-1 ③0.0500mol·L-1
(4)若采用上述最合适浓度的标准NaOH溶液满定,滴定时实验数据列表如下:
实验次数编号 | 待测盐酸体积(mL) | 滴入NaOH溶液体积(mL) |
1 | 10.00 | 8.48 |
2 | 10.00 | 8.52 |
3 | 10.00 | 8.00 |
求这种待测稀盐酸的物质的量浓度c(HCl)=___________________。
(5)在滴定操作过程中,以下各项操作使测定值偏高的有:_______________
①滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗
②滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡
③滴定前平视,滴定终了俯视
④看到颜色变化后立即读数
⑤洗涤锥形瓶时,误把稀食盐水当做蒸馏水进行洗涤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com