
科目: 来源: 题型:
【题目】(1)SO2的相对分子质量为___,其摩尔质量为____。
(2)标准状况下,0.5 mol任何气体的体积都约为____。
(3)4gH2与标准状况下22.4LSO2相比,所含分子数目较多的是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】粗铜中一般含有锌、铁、银、金等杂质.在如图3所示装置中,甲池的总反应方程式为:C2H5OH+3O2+4KOH=2K2CO3+5H2O 接通电路一段时间后,纯Cu电极质量增加了6.4 g。在此过程中,下列说法正确的是
A. 电子流向A→D→C→B
B. 乙池硫酸铜溶液的浓度不变
C. 甲池氧气消耗2.24 L
D. 甲池负极反应式为C2H5OH-12e﹣+16OH﹣=2CO32﹣+11H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g)在恒容密闭容器中反应,达到平衡状态的标志是①单位时间内生成n molO2 的同时消耗 2n mol NO;②单位时间内消耗2n molNO2的同时生成n molO2;③混合气体的颜色不再改变的状态;④2v(NO2)正= v(O2)逆;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体的密度不再改变的状态
2NO(g)+O2(g)在恒容密闭容器中反应,达到平衡状态的标志是①单位时间内生成n molO2 的同时消耗 2n mol NO;②单位时间内消耗2n molNO2的同时生成n molO2;③混合气体的颜色不再改变的状态;④2v(NO2)正= v(O2)逆;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体的密度不再改变的状态
A. ①③⑤ B. ②④⑥ C. ①③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法错误的是
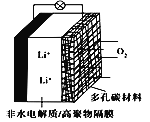
A. 放电时,多孔碳材料电极为正极
B. 放电时,外电路电子由锂电极流向多孔碳材料电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-0.5 x)O2
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)蒸馏的装置及主要仪器,请写出所指仪器的名称。

①______②______③______④_____⑤______⑥______⑦______
(2)物质的体积大小取决于____、_____、____。
(3)使用22.4L/mol需注意:物质状态必须为____,条件必须是____,22.4L/mol是个___值。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关电化学知识的描述正确的是

A. Cu+H2SO4= CuSO4+H2↑这个反应可设计成原电池。
B. 利用Cu+2FeCl3=CuCl2+2FeCl2,可设计如图所示原电池装置,盐桥内K+向FeCl3溶液移动。
C. 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,铁作负极,铜作正极,其负极反应式为Fe-2e-=Fe2+。
D. 由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为Mg-2e-+2OH-=Mg(OH)2。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A. 每生成2分子AB吸收b kJ热量
B. 该反应热ΔH=+(a-b) kJ·mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
又知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是
A. P-P键的键能大于P-Cl键的键能
B. 可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C. Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1
D. P-P键的键能为(5a-3b+12c)/8 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中两种物质分子数相同的是( )
A. 1gH2和8gO2
B. 1molHCl和11.2LCO(标准状况)
C. 18gH2O和22.4LCO2(标准状况)
D. 6.02×1023个氯分子和0.5molN2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com