
科目: 来源: 题型:
【题目】“反向燃烧”可将二氧化碳变为燃料。回答下列问题:

(已知甲烷的标准燃烧热ΔH=-890 kJ·mol-1) 。
(1)科学家用氮化镓材料与铜组装如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
①写出铜电极表面的电极反应式:_________________________;
②该总反应的热化学方程式为:___________________________,
(2)利用CO2与H2反应可制备CH4。
已知氢气的标准燃烧热ΔH=-286 kJ·mol-1 ;H2O(g) = H2O (l),ΔH=-44kJ·mol-1;
则二氧化碳与氢气反应生成甲烷和水蒸气的热化学方程式为_____________________;
该反应能自发的条件是__________(填高温或低温)。
查看答案和解析>>
科目: 来源: 题型:
【题目】K2Cr2O7是一种有致癌性的强氧化剂,含Cr2O72—的酸性工业废水必须经过处理才能排放。工业上通常采用Fe电极电解法处理,调节pH值使之以Cr(OH)3沉淀形式除去。某化学兴趣小组在实验室里探究了该处理工艺,具体实验日志如下:
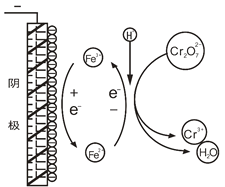
I.原理探查
查阅文献发现,电解时阳极产生Fe2+,在阴极附近(如图),Cr2O72—被Fe2+还原成Cr3+,而Fe3+则在阴极表面还原为Fe2+,如此循环。
(1)用离子方程式表示Cr2O72—与Fe2+的反应:______________________________。
II.实验探究
实验一:探究不同电压对Cr2O72-降解效率的影响
各取6份100 mL 1 mol/L 酸性K2Cr2O7溶液,均以Fe为电极,分别用不同电压电解5 min。取电解后溶液10 mL,测定Cr2O72-的含量,所测溶液中Cr2O72-物质的量与电解电压关系如下图所示。(假设电解前后溶液体积不变)
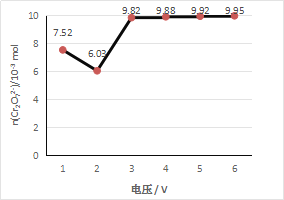
(2)实验结果显示,最佳电解电压应选择_______V。
(3)电压为6 V时,用Cr2O72-表示5 min内平均反应速率为_________mol·L—1·min—1。
(4)当电压高于3 V时,阴阳两极在电解过程中不断有气泡产生,且测得体积比约等于2:1。因此,阳极产生气泡的电极反应式为:__________________________________。
实验二:探究其他影响Cr2O72-降解效率的因素
以1A电流电解500mL K2Cr2O7稀溶液,通电时间30min,考察影响Cr2O72-降解效率的其他因素。具体方法和数据如下表所示。
实验组 | ① | ② | ③ | ④ | |
加入硫酸铁 /g | 0 | 0 | 5.0 | 0 | |
加入浓硫酸 /mL | 0 | 1.0 | 1.0 | 1.0 | |
电极材料 | 阴极 | 石墨 | 石墨 | 石墨 | 石墨 |
阳极 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2O72-浓度 / mol·L-1 | 初始 | 0.00651 | 0.00651 | 0.00651 | 0.00651 |
结束 | 0.00645 | 0.00568 | 0.00516 | 0.00278 | |
(5)以上实验中,Cr2O72-降解效率最高的是实验组_____(填编号),该实验组阳极电极反应式为:__________________________________。
(6)对比②和③,Cr2O72-降解效率③>②的原因是:__________________________。
(7)由实验组①和②,可认为Cr2O72-能直接在阴极放电还原,电极反应式为:__________________________________。
(8)法拉第提出了电解定律,为电化学的发展作出了巨大贡献。根据法拉第电解定律: Q=It=n(e-)F,[I为电流强度单位为A,t为时间单位为s,n(e-)为通过电路的电子的物质的量,F为法拉第常数(每摩电子电量,F=96500 C·mol-1)],则实验组②中的电流效率![]() =______________。(保留三位有效数字;假设电解前后溶液体积不变,且没有副反应发生。)
=______________。(保留三位有效数字;假设电解前后溶液体积不变,且没有副反应发生。)
查看答案和解析>>
科目: 来源: 题型:
【题目】将2.8 g CO和0.2 g H2在足量的氧气中充分燃烧,使生成的CO2和水蒸气通过过量的过氧化钠,完全反应后固体的质量变化量是( )
A. 增加了3.0 gB. 减少了3.0 gC. 增加了2.6 gD. 减少了2.6 g
查看答案和解析>>
科目: 来源: 题型:
【题目】如下反应条件的控制中,不恰当的是( )
A.为防止铁生锈,在其表面涂一层防锈油漆
B.为防止火灾,在面粉厂、加油站等场所要严禁烟火
C.为加快KClO3的分解速率而加入MnO2
D.降温加快H2O2的分解速率
查看答案和解析>>
科目: 来源: 题型:
【题目】36.5g氯化氢溶解在1L水中(水的密度近似为1g·mL-1),所得溶液的密度为ρg·mL-1,质量分数为w,物质的量浓度为cmol·L-1,NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
A. 所得溶液的物质的量浓度为1mol·L-1B. 36.5g氯化氢含有NA个原子
C. 36.5gHCl气体占有的体积约为22.4LD. 所得溶液的质量分数w=36.5c/1000ρ
查看答案和解析>>
科目: 来源: 题型:
【题目】利用氢气对废气进行脱碳处理可实现绿色环保、废物利用,对于减少雾霾也具有重要意义。
(1)汽车尾气的主要污染物为NO,用H2催化还原NO可以达到消除污染的目的。
已知:2NO(g) ![]() N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是______________。
(2)某研究小组模拟研究如下:向2 L恒容密闭容器中充入2 mol NO发生反应2NO(g) ![]() N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:

①T2下,在0~5 min内,v(O2)=______________mol·L-1·min-1;该温度下反应N2(g)+O2(g) ![]() 2NO(g)的平衡常数K=______________。
2NO(g)的平衡常数K=______________。
②该反应进行到M点放出的热量______________进行到W点放出的热量(填“>”、“<”或“=”)。
M点时再加入一定量NO,平衡后NO的转化率______________(填“变大”、“变小”或“不变”)。
③反应开始至达到平衡的过程中,容器中下列各项发生变化的是______________(填序号)。
a.混合气体的密度 b.逆反应速率
c.单位时间内,N2和NO的消耗量之比 d.气体的平均相对分子质量
(3)氢气作为一种理想燃料,但不利于贮存和运输。利用氢能需要选择合适的储氢材料,镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g) ![]() LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
A.增加LaNi5H6(s)的量 B.升高温度
C.使用催化剂 D.减小压强
查看答案和解析>>
科目: 来源: 题型:
【题目】E是一种环保型塑料,其合成路线如下:

已知:①
② (R1、R2、R3、R为烃基)
(R1、R2、R3、R为烃基)
请回答下列问题:
(1)A中官能团的名称是____________,检验该官能团的试剂为___________________。
(2)反应①的化学方程式是:______________________________,其反应类型为________________,在反应①中,还可以得到另一种分子式为C10H16的化合物,其结构简式为___________________。
(3)已知,![]() 名称为丙酮酸,则C的系统命名法命名应为____________________。
名称为丙酮酸,则C的系统命名法命名应为____________________。
(4)写出反应④的化学方程式:______________________________。
(5)C的同分异构体X满足下列条件:
①常温下,与碳酸钠溶液反应放出气体;
②能发生银镜反应。则符合条件的X共有________种。其核磁共振氢谱共有四组峰且峰面积之比为1∶1∶2∶2,则X的结构简式为________________。
(6)参照E的上述合成路线,设计一条由4一甲基一3一戊酮酸为起始原料制备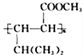 的合成路线(无机试剂任选)_________________________________________。
的合成路线(无机试剂任选)_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中Cl-浓度与50 mL 1 mol·L-1AlCl3溶液中Cl-浓度相等的是( )
A. 150 mL 1 mol·L-1的NaCl溶液B. 75 mL 2 mol·L-1NH4Cl溶液
C. 150 mL 2 mol·L-1的KCl溶液D. 100 mL 1.5mol·L-1的MgCl2溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】已知乙苯制备苯乙烯的反应为:![]()
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/KJ/mol | 412 | 348 | 612 | 436 |
下列说法错误的是
A. 上述反应的△H=+124kJmol﹣1 B. 乙苯比苯乙烯稳定
C. 乙苯中不存在碳碳双键 D. 1mol乙苯的能量与1mol苯乙烯能量相差264kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是
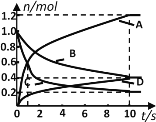
A. 反应进行到1s时,v (A)=v (C)
B. 反应进行到10s时,各物质的反应速率相等
C. 反应进行到10s时,A的平均反应速率为0.06 mol/(L·s)
D. 该反应的化学方程式为6A+3B![]() 4C+2D
4C+2D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com