
科目: 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:NO(g)+CO(g)![]() 1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂、漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
(查阅资料)资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液

回答下列问题:
(1)各装置的连接顺序为____→_____→_____→____→E;
(2)装置 A 中反应的离子方程式是__________________;
(3)装置 E中反应的化学方程式是_____________________;
(4)装置 B 中多孔球泡和搅拌棒的作用是____,反应过程中,装置B需放在冷水中,其目的是____。
(5)装置C的主要作用是_____________________;
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)______________。
(7)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为___g。
(8)配平下列离子方程式:______Fe(OH)3+ ClO![]() + OH
+ OH![]() — FeO42-+ Cl-+ H2O。
— FeO42-+ Cl-+ H2O。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用0.02mol/L的NaOH溶液,分别滴定浓度为0.0lmol/L的三种稀酸溶液,滴定的曲线如右图所示,下列判断正确的是

A. 三种酸均为弱酸,且同浓度的稀酸中导电性:HA<HB<HD
B. 滴定至P点时,溶液中:c(HB)>c(B-)
C. 溶液呈中性时,三种溶液中:c(A-)>c(B-)>c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,下列说法不正确的是

A. 由图可知:乙酸的生成速率随温度升高而升高
B. 250~300℃时,温度升高而乙酸的生成速率降低的主要原因是催化剂的催化效率降低
C. 由300~400℃可知,其他条件相同时,催化剂的催化效率越低,乙酸的生成速率越大
D. 根据图象推测,工业上制备乙酸最适宜的温度应为250℃
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)研究氯气跟金属的反应时,选用金属铜进行实验。用坩埚钳夹住一束铜丝,灼热后立刻放入充满氯气的集气瓶里。铜丝燃烧后把少量水注入集气瓶里,用玻璃片盖住瓶口,振荡。
①根据哪些实验现象可判断铜丝燃烧后生成了+2价铜的化合物:_______________。
②反应的化学方程式为______________________________________________________。
(2)研究浓硫酸的强氧化性时,选用金属铜跟浓硫酸进行实验,实验装置如下图所示。
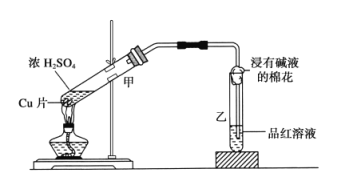
①乙中的现象_______,试管中的浸有碱液的棉花的作用是____________。
②甲中的反应方程式为_____________________________________。
(3)上述两个实验为什么都选金属铜作样本来进行实验________。
A.铜是一种不活泼金属
B.选用铜作实验可以推测更多金属跟氯气或浓硫酸反应的情况
C.铜是一种常见金属
D.铜跟氯气或浓硫酸反应可生成有色溶液,现象明显
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸钠-过氧化氢加合物的化学式可表示为xNa2SO4·yH2O2·zH2O,(其中x、y、z为各成分物质的量的最简整数比),其化学式可通过下列实验测定:
①准确称取1.7700g样品,配制成100mL溶液A;
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液与Na2SO4反应至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g;
③准确量取25.00mL溶液A,加入适量稀硫酸酸化后,用0.02000 mol·L-1KMnO4溶液与H2O2反应,消耗KMnO4溶液0.0005mol。
H2O2与KMnO4反应的方程式如下:2KMnO4+5H2O2+3H2SO4=2MnSO4+5O2↑+ K2SO4+8H2O
计算1.7700g样品中:
(1)Na2SO4的物质的量。_____
(2)H2O2的物质的量。______
(3)该硫酸钠-过氧化氢加合物的化学式。______
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生反应:2A(g)+B(g)![]() 2C(g),经2 s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是( )
2C(g),经2 s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是( )
A. 用物质A表示反应的平均速率为0.3 mol·L-1·s-1
B. 用物质B表示反应的平均速率为0.3 mol·L-1·s-1
C. 2 s时物质A的转化率为70%
D. 2 s时物质B的浓度为0.3 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:H2(g)+Cl2(g)![]() 2HCl(g)的反应能量变化示意图如下。下列说法不正确的是
2HCl(g)的反应能量变化示意图如下。下列说法不正确的是

A. 键的断裂过程是吸热过程,键的形成过程是放热过程
B. “假想的中间物质”的总能量高于起始态H2和Cl2的总能量
C. 反应的△H=[(a+b)-2c]kJ/mol
D. 点燃条件和光照条件下,反应的△H不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com