
科目: 来源: 题型:
【题目】现有前四周期A,B,C,D,E、X六种元素,已知B,C,D,E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
(1)写出C,D,E三种原子第一电离能由大到小的顺序为__。
(2)A原子与B,C,D原子形成最简单化合物的稳定性由强到弱的顺序为__,根据价层电子对互斥理论预测BA2D的分子构型为__。
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个BC﹣.与A同族且相差两个周期的元素R的离子位于立方体的恰当位置上,根据其结构特点可知该晶体的化学式为____(用最简正整数表示)。
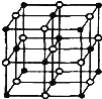
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表:

根据表格中的数据:判断KCl、MgO、TiN 三种离子晶体熔点从高到低的顺序是__,MgO晶体中一个Mg2+周围和它最邻近且等距离的O2﹣有__个。
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好,离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】由![]() 和
和![]() 组成的混合气体与同温同压下空气的密度相等
组成的混合气体与同温同压下空气的密度相等![]() 空气的平均相对分子质量为29,
空气的平均相对分子质量为29,![]() 则下列关系正确的是()
则下列关系正确的是()
A.混合气体中,![]() 占有的体积大于
占有的体积大于![]() 占有的体积
占有的体积
B.混合气体中,![]() 与
与![]() 分子个数比为1:2
分子个数比为1:2
C.混合气体中,![]() 与
与![]() 质量比为15:14
质量比为15:14
D.混合气体中,![]() 与
与![]() 密度比为14:15
密度比为14:15
查看答案和解析>>
科目: 来源: 题型:
【题目】I.甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g)![]() HCHO(g)+H2(g) △H1=+85.2kJ/mol
HCHO(g)+H2(g) △H1=+85.2kJ/mol
反应II:CH3OH(g)+![]() O2(g)
O2(g)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
反应III:2H2(g)+O2(g)![]() 2H2O(g) △H3=-483.6kJ/mol
2H2O(g) △H3=-483.6kJ/mol
(1)计算反应Ⅱ的反应热△H2=_____________________________。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g)![]() HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
II.CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(3)CO2用于生产乙烯,已知:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=QkJ/mol。一定条件下,按不同的投料比X[X=
CH2=CH2(g)+4H2O(g) △H=QkJ/mol。一定条件下,按不同的投料比X[X=![]() ]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。

①X1_____X2(填“>”或“<”,后同),Q_____0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为_____。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=_____[常温下K1(H2CO3)=4.4×10﹣7、K2(H2CO3)=5×10﹣11]。
②欲用5L Na2CO3溶液将23.3g BaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________。[已知:常温下Ksp(BaSO4)=1×10﹣7、Ksp(BaCO3)=2.5×10﹣6]。(忽略溶液体积积的变化)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示土壤中甲、乙两种元素浓度变化与某植物生长速率的关系,下列分析中正确的是

A. 该植物生长对甲元素的需要大于乙元素
B. 在B浓度下施含乙元素的肥料最有利于该植物生长
C. 当该植物生长速率最大时对甲、乙元素的需要量相近
D. 持续保持甲、乙元素供应量相等将导致该植物生长不正常
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各选项中,各类物质依次表示为X、Y、Z,其中与图中三个圆所示的从属关系不相符的是:

A. 氧化物、化合物、纯净物
B. 碱性氧化物、金属氧化物、氧化物
C. 胶体、分散系、混合物
D. 复分解反应、置换反应、化学反应
查看答案和解析>>
科目: 来源: 题型:
【题目】阿司匹林是一种常用的治感冒药,其结构简式如图所示,下列有关阿司匹林的说法正确的是

A. 1mol阿司匹林最多能与5mol H2反应
B. 1mol阿司匹林最多能与1molNaHCO3反应
C. 1mol阿司匹林最多能与2mol NaOH反应
D. 1mol阿司匹林与足量的Na反应生成ImolH2
查看答案和解析>>
科目: 来源: 题型:
【题目】碲(52Te)被誉为“现代工业、国防与尖端技术的维生素”,工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:

已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)碲在元素周期表中的位置_______________。
(2)“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是___________________,其中“加压”的目的是_______________,写出“加压酸浸1”过程中Cu2Te发生反应的化学方程式__________________________。
(3) “酸浸2”时温度过高会使碲的浸出率降低,原因为______________________,要从Ag和Au中分离出Au,可以向回收的Ag和Au中加入的试剂是_______________。
(4)写出“还原”反应中发生的离子方程式_______________________。
(5)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,以石墨为电极电解溶液获得Te。电解过程中阴极的电极反应式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是

A. 电池总反应为:N2H4+2O2=2NO+2H2O
B. 电池内的O2-由电极乙移向电极甲
C. 当甲电极上有lmol N2H4消耗时,乙电极上有22.4LO2参与反应
D. 电池正极方程式为:O2 + 4e-+2H2O=4OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如下。下列说法正确的是( )

A.若a点pH=4,且c(Cl-)=m c(ClO-),则Ka(HClO)=![]()
B.若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH
C.若y=200,c点对应溶液中:c(OH-)—c(H+)=2c(Cl-)+c(HClO)
D.b~c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目: 来源: 题型:
【题目】二异丙烯基苯是工业上常用的交联剂,可用于制备高性能超分子聚合物,其结构如下图所示。下列有关二异丙烯基苯的说法错误的是

A. 在催化剂存在下可发生加聚反应
B. 与溴水混合后加入铁粉可发生取代反应
C. 分子中所有碳原子可能都处于同一平面
D. 其一氯代物有5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com