
科目: 来源: 题型:
【题目】实验室研究不同价态元素的转化,对于物质的制备和应用至关重要。
(1)实验室可以用如右图所示装置研究S(+6)→S(+4)。

①装置C的作用是___________;
②B、D盛放的试剂分别应为___________、___________(填字母标号)
a.BaCl2溶液
b.KI淀粉溶液
c.FeSO4溶液
d.NaOH溶液
e.品红
③实验结束后,发现A中溶液几乎为无色,且试管中有较多的白色固体。试管中溶液显无色,体现了浓硫酸的___________性质;
④实验结束后,若要证明A中白色固体为CuSO4,需要采取的操作是___________。
(2)硫代硫酸钠(Na2S2O3)是用途广泛的化工产品。某同学欲探究其能否用做脱氯剂(除去游离氯),设计如图所示的实验。

已知:S2O32-+2H+=S↓+SO2↑+H2O
①烧瓶中发生反应的化学方程式为___________;
②若要判断Na2S2O3能否做脱氯剂,该同学还需要进行的实验是___________;
③I2标准溶液是测定硫代硫酸钠纯度的重要试剂,其浓度可以通过基准物质As2O3来标定:称取a g As2O3置于锥形瓶中,加人适量NaOH恰好将As2O3转化成Na3AsO3,加入淀粉溶液做指示剂,再用I2溶液进行滴定,消耗I2标准溶液体积为v mL。
i.滴定反应(产物之一是AsO43-)的离子方程式为______________________;
ii.I2标准溶液的物质的量浓度为___________。(用含a、v的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】塑化剂(DEHP)的一种合成路线如下:

已知:①有机物分子中,同一个碳原子上连接两个羟基时不稳定,会自动脱水。
②
请回答下列问题:
(1)DEHP分子的官能团名称___________,B的名称___________。
(2)反应I、IV的类型分别为___________、___________;反应Ⅲ的条件___________。
(3)E的结构简式___________。
(4)反应V的化学方程式___________;
(5)符合下列条件的C的同分异构体共有___________种,写出其中一种的结构简式___________。
①遇FeCl3溶液显紫色 ②能发生银镜反应
③苯环上有三个取代基 ④能与 NaHCO3反应放出CO2气体
(6)请参考上述合成路线,以苯甲醇、正丁醇为原料,无机试剂任选,写出合成G(结构式如右)的路线流程图。合成路线流程图示例如下:
![]()

答:_______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究含碳化合物的结构与性质,对生产、科研等具有重要意义
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+计与X的空腔大小相近,恰好能进入到X的环内,且Li+与氧原子的一对孤电子对作用形成稳定结构W(如图)。
a.基态锂离子核外能量最高的电子所处能层符号为___________;
b.W中Li+与孤对电子之间的作用属于___________(选填字母标号)
A.离子键 B.共价键 C.配位键 D.氢键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+计形成稳定结构。理由是___________。
③烯烃难溶于水,被KMnO4水溶液氧化的效果较差。若烯烃中溶人冠醚Z,氧化效果明显提升。
i.水分子中氧的杂化轨道的空间构型是___________,H-O键键角___________(填“>”“<”或“=”)109°28′
ii.已知:冠醚Z与KMnO4可以发生右图所示的变化。加入冠醚Z后,烯烃的氧化效果明显提升的原因是___________。
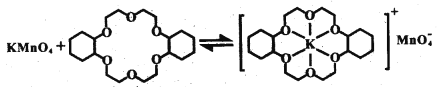
(2)甲烷是重要的清洁能源,其晶体结构如图所示,晶胞参数为anm。
①常温常压下不存在甲烷晶体。从微粒间相互作用的角度解释,其理由是___________;
②甲烷分子的配位数为___________;
③A分子中碳原子的坐标参数为(0,0,0),则B分子的碳原子的坐标参数为___________。
④甲烷晶体的密度为___________(g·cm-3)。

查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C和甲、乙、丙均是由短周期元素形成的物质,D是过渡元素形成的常见单质,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)

请回答下列问题:
(1)丙的电子式为_____;组成气体乙的元素在周期表的位置____;物质B含有的化学键类型是______;
(2)写出下列反应的离子方程式:
④ _________________________;
⑤ _____________________;
(3)金属D与稀硝酸反应,产生标准状况下1.12L的NO气体,则参加反应的硝酸为_______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮氧化物是环境污染物,研究氮氧化物转化有重要的意义。
回答下列问题
(1)催化转化器可使汽车尾气反应而转化:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
已知:N2(g)+O2(g)==2NO(g) △H1= a kJ·mol-1
2C(s)+O2(g)==2CO(g) △H2= b kJ·mol-1
C(s)+ O2(g)=CO2(g) △H3= c kJ·mol-1
△H=___________ kJ·mol-1(用含a、b、c的代数式表示)
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中发生尾气转化反应,容器中NO物质的量随时间变化如图所示。

①T℃时,该化学反应的平衡常数K=___________。
②下列事实无法判断汽车尾气转化反应达到到化学平衡状态的是___________;
A.NO消耗速率等于N2消耗速率的2倍 B.混合气体平均相对分子质量不再变化
C.体系中NO的转化率和CO的转化率相等 D.气体的密度不再变化
③已知汽车尾气转化反应的△H<0。10min后,改变下列示意图横坐标对应的反应条件,纵坐标对应的量变化关系正确的是___________。(填序号)

(3)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)0.5(k为速率常数)。下列表述正确的是___________(填标号)。
A.N2O分解反应中,k值与是否含碘蒸气无关
B.第二步对总反应速率起决定作用
C.第二步活化能比第三步小
D.IO为反应的中间产物
(4)碱吸收、碳还原是目前工业生产中处理氮氧化物的常用方法。
①碱吸收的常见产物为NaNO2。常温下,pH=8的NaNO2溶液中c(Na+)-c(NO2-)=___________mol·L-1(用精确值表示)
②碳还原法是在高温条件下将NO与NO2混合气体与焦炭反应,生成CO和N2。已知,采用碳还原法处理某工厂氮氧化物废气时,生成的CO与N2的物质的量之比为4︰3。则该工厂尾气中NO和NO2的物质的量比为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入等质量的X、Y两种气体,且X、Y的气体密度相等。当隔板停止滑动时,下列说法正确的是

A.气体的体积:V(X)>V(H2)>V(Y)
B.物质的量:n(X)<n(H2)<n(Y)
C.X的相对分子质量比Y的相对分子质量小
D.X的相对分子质量等于Y的相对分子质量
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)现有Na2CO3和NaHCO3两种白色固体物质:
Ⅰ.欲探究Na2CO3和NaHCO3稳定性的相对强弱,两同学分别设计了以下两组装置:

请回答:
①如甲图所示,分别用Na2CO3和NaHCO3做实验,试管②中的试剂是______(填字母序号)。
a. 稀H2SO4 b. NaOH溶液 c. Ca(OH)2溶液
②如乙图所示,试管④中装入的固体应该是______________(填化学式)。
③通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性______(填“强”或“弱”)。
Ⅱ.欲鉴别两种固体物质可选用的试剂是_____________。
Ⅲ.等物质的量浓度的两种物质的溶液与同浓度的盐酸反应,反应速率快的是_________(填化学式)。
(2)甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请回答下列问题:



①实验室制取氨气的化学方程式为:________________________________________;
②三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(假设他们的实验操作都正确),你认为没有收集到氨气的同学是___________(填“甲”、“乙”或“丙”),收集不到氨气的主要原因是___________________________(用化学方程式表示);
③检验氨气是否收集满的方法是(简述操作方法、现象和结论)_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝是一种活泼的金属,在高温下能与Fe2O3反应生成Fe和Al2O3。该反应中___________(填化学式)是还原剂,_____________(填化学式)氧化剂。当2molFe2O3参加反应时,转移了 ____________ mol电子。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:pKa=-lgKa。25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1 mol·L-1 NaOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如图所示。下列说法不正确的是

A. a点溶液中:c(HA-)=c(H2A)
B. b点溶液中:A2-水解平衡常数Kh1=10-6.81
C. c点溶液中:V0=30
D. a、b、c、d四点中,d点溶液中水的电离程度最大
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名![]() ,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的电子数
C. TS在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com