
科目: 来源: 题型:
【题目】实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:

已知几种金属阳离子形成氢氧化物沉淀时的pH如下表

回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有______________________(任写两种)。
(2)气体X的电子式为___________,滤渣1经过处理可以制得一种高效的无机高分子混凝剂、净水剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为___________。
(3)加入H2O2的目的是___________;若将上述过程中的“H2O2”用“ NaClO”代替也能达到同样目的,则发生反应的离子方程式为_________________________________。
(4)“一系列操作”主要包括加入足量盐酸,然后经过______________________、过滤、洗涤,即得到氯化镁晶体。
(5)准确称取2.000g氯化镁晶体产品于250mL锥形瓶中,加水50mL使其完全溶解,加入100mL氨性缓冲液和少量铬黑T指示剂,溶液显酒红色,在不断震荡下,用0.5000mol·L-1的EDTA标准溶液进行滴定,其反应原理为Mg2++Y4-=MgY2-,滴定终点时消耗EDTA标准溶液的体积19.00mL。
①则产品中MgCl2·6H2O的质量分数为___________(结果保留3位有效数字)。
②下列滴定操作会导致测量结果偏高的是___________(填宇母)。
a.锥形瓶洗涤后没有干燥 b.滴定时锥形瓶中有液体溅出
c滴定终点时俯视读数 d滴定管滴定前有气泡,滴定后气泡消失
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以某软锰矿(主要成分为MnO2,还含有SiO2、Al2O3等杂质)为原料,利用烟道气中的SO2制备MnSO4·H2O的流程如下:
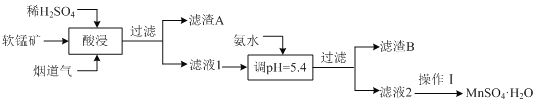
(1)滤渣A的主要成分是_________(填化学式)。
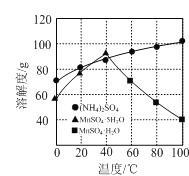
(2)操作Ⅰ为加热(煮沸)结晶、趁热过滤、洗涤、干燥。根据下图溶解度曲线分析,趁热过滤的目的除了防止MnSO4·H2O中含有(NH4)2SO4外,还有____________________。
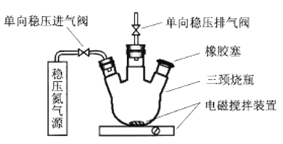
(3)MnSO4常用于测量地表水的DO值(每升水中溶解氧气的质量,即溶氧量)。我国《地表水环境质量标准》规定,生活饮用水源的DO值不得低于5 mg·L-1。李明同学设计了如下实验步骤测定某河水的DO值:
第一步:使如图所示装置中充满N2后,用注射器向三颈烧瓶中加入200 mL水样。
第二步:用注射器向三颈烧瓶中依次加入一定量MnSO4溶液(过量)、碱性KI溶液(过量),开启搅拌器,发生下列反应:Mn2++O2+OH-→MnO(OH)2↓(未配平)
第三步:搅拌并向烧瓶中加入一定量H2SO4溶液,在酸性条件下,上述MnO(OH)2将I-氧化为I2,其反应如下: MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平)
第四步:从烧瓶中取出40.00 mL溶液,与0.010 mol·L-1Na2S2O3溶液发生反应:2S2O32—+I2=S4O62—+2I-,恰好完全进行时,消耗Na2S2O3溶液4.40 mL。
①在配制第二、三步所加试剂时,所有溶剂水须先煮沸后再冷却才能使用,将溶剂水煮沸的作用是_____。
②通过计算判断作为饮用水源,此河水的DO值是否达标______ (写出计算过程,不考虑第二、三步加入试剂后水样体积的变化)。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

(1) 检验某无色溶液中含有碘离子的方法__________。
(2)步骤③的实验操作名称是_____;用到的玻璃仪器除烧杯、漏斗外还有__________。
(3)在浸泡时含有碘离子的物质溶于水的过程包含两个过程。一个是物理过程,这个过程要___热量:另一个是化学过程,它是________的过程,这一过程要放出热量。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是________。

(5)另一个学习小组用CCl4萃取碘水,如图的分液漏斗中,下层液体呈_____色;他们打开分液漏斗活塞,却未见液体流下,原因可能是_______(写一种可能)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有机反应方程式书写正确的是
A. 甲烷与氯气的取代反应:CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B. 苯与硝酸的硝化反应:![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
C. 乙醇的催化氧化反应:CH3CH2OH+O2![]() CH3CHO+H2O
CH3CHO+H2O
D. 乙酸与乙醇的酯化反应:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目: 来源: 题型:
【题目】以海水为电解质的Mg-AgCl电池在军事上可用作电动鱼雷的电源,其电池反应离子方程式为:2AgCl+Mg=Mg2++2Ag+2Cl-。该电池工作时,下列说法正确的是

A. 正、负极的质量均减少 B. AgCl电极发生氧化反应
C. 电子由AgCl经外电路流向Mg D. 实现了电能向化学能的转化
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化铬(CrN)是一种良好的耐磨材料,实验室可用无水氯化铬(CrCl3)与氨气在高温下反应制备,反应原理为CrCl3+NH3![]() CrN+3HCl。无水氯化钙对氨气具有突出的吸附能力,其吸附过程中容易膨胀、结块。回答下列问题:
CrN+3HCl。无水氯化钙对氨气具有突出的吸附能力,其吸附过程中容易膨胀、结块。回答下列问题:
(1)制备无水氯化铬。氯化铬有很强的吸水性,通常以氯化铬晶体(CrCl3·6H2O)的形式存在。直接加热脱水往往得到Cr2O3,有关反应的化学方程式为___________________________。以氯化铬晶体制备无水氯化铬的方法是_________________________________。
(2)制备氮化铬。某实验小组设计制备氮化铬的装置如下图所示(夹持与加热装置省略):

①装置A中发生反应的化学方程式为____________________________________________。
②实验开始时,要先打开装置A中活塞,后加热装置C,目的是______________________。
③装置B中盛放的试剂是___________,装置D的作用是______________________。
④有同学认为该装置有一个缺陷,该缺陷是______________________。
(3)氮化铬的纯度测定。制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN与Cr2N的物质的量之比为___________。
(4)工业上也可用Cr2O3与NH3在高温下反应制备CrN。相关反应的化学方程式为___________,提出一条能降低粗产品中氧含量的措施:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。
⑴甲醇脱氢法可制备甲醛,反应方程式为CH3OH![]() HCHO+H2。
HCHO+H2。
①发生反应时的过程如图所示,从热效应角度判断,可知该反应为______反应。

②下列方法中能减慢反应速率的是______(填字母)。
a.使用催化剂 b.升高温度 c.降低反应物浓度
③使用催化剂________(填“能”或“不能”)使反应物的转化率达到100%。
⑵甲醛超标会危害人体健康,需对甲醛含量检测及处理。
①某甲醛气体探测仪利用燃料电池工作原理,其结构如图所示。电极a为______(填“正”或“负”)极,在电极b上发生的反应类型为______反应。(填“氧化”或“还原”)

②探测仪工作时,电子从______极流出(填“a”或“b”),总反应方程式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物I(C9H12O2)是合成某功能高分子材料的中间体,由C2H4和![]() 合成的路线如图所示:
合成的路线如图所示:

已知:i、RCHO+CH3CHO![]() RCH=CHCHO+H2O(R为代表烃基或氢原子)
RCH=CHCHO+H2O(R为代表烃基或氢原子)
ii、![]()
回答下列问题:
(1)试剂X的名称______________________。
(2)E的结构简式为______________________。
(3)反应④的类型是______________________。
(4)D中所含的官能团名称是______________________。
(5)写出反应⑤的化学方程式:_________________________________。
(6)同时符合下列条件的I的同分异构体共有___________种(不考虑立体异构),其中核磁共振氢谱图表明分子中有5种氢原子的为___________(写1种结构简式)。a.分子中含有苯环且苯环上有三个取代基;b.1mol有机物最多能消耗2 mol NaOH。
(7)设计以乙醛和1,3-丁二烯(CH2=CHCH=CH2)为原料制备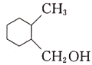 的合成路线:________ (用流程图表示,无机试剂任选)。
的合成路线:________ (用流程图表示,无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,它们的原子最外层电子数总和等于Z的原子序数,由这四种元素组成一种化合物M具有如下性质下列推断正确的是

A. 原子半径:Z>Y>X>W
B. 最高价氧化物对应的水化物酸性:Y>X
C. 简单阴离子的还原性:W<Z
D. W、Y、Z组成的化合物只含共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com