
科目: 来源: 题型:
【题目】某温度下,在容积为2L的密闭容器中充入5mol气体A和3mol气体B,发生反应:3A(g)+B(g)![]() 2C(g)+2D(g),5分钟后反应达到平衡状态,测得生成2molD,计算以下量(写出计算过程):
2C(g)+2D(g),5分钟后反应达到平衡状态,测得生成2molD,计算以下量(写出计算过程):
(1)计算A的转化率。
(2)计算该温度下该反应的化学平衡常数。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图装置进行有关实验。请回答:
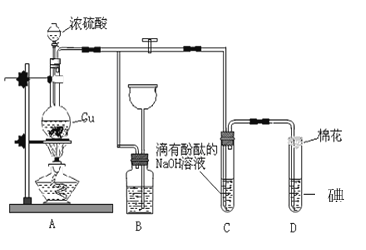
(1)装置A中发生的化学反应的化学方程式: _________________________________。
(2)装置B 的作用是__________________,B中广口瓶内应盛放的液体是_________(填序号)
①水 ②澄清石灰水
③Na2CO3溶液 ④饱和的NaHSO3 溶液
(3)装置C和D 中产生的现象相同,但原因却不同。C中反应的方程式:_______________________________________,而D 中则是由于SO2 具有_______性,D中反应的方程式:________________________。
(4)实验中,0.1molCu与含0.2mol硫酸的溶液反应后,铜和硫酸都有剩余。 可以证明有余酸的实验方案是___________
A.可再加入锌粒 B.可再加入氯化钡溶液
C.再加入银粉 D.再滴入碳酸氢钠溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】已知3CuO+2NH3![]() 3Cu+N2+3H2O。下列判断正确的是
3Cu+N2+3H2O。下列判断正确的是
A.N元素的化合价降低B.NH3被还原
C.消耗0.3 mol CuO转移0.6 NA个电子D.CuO是还原剂
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制硝酸的主要反应是4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-1025 kJ·mol-1
4NO(g)+6H2O(g) ΔH=-1025 kJ·mol-1
(1)该反应的平衡常数表达式为K=________;升高温度,K值______(填“增大”或“减小”或 “不变”);升高温度,化学反应速率将______(填“增大”或“减小” 或 “不变”)。
(2)若反应物起始的物质的量相同,下列关系图正确的是______(填序号)。

(3)若达到平衡状态后升高温度则正反应速率和逆反应速率___________________ 。(填“同时增大”或“逆反应速率增大,正反应速率不变”)
(4)工业上合成氨气的反应N2(g)+3H2(g) ![]() 2NH3(g)ΔH<0 ,在密闭容器中反应达到平衡状态的标志是_______。
2NH3(g)ΔH<0 ,在密闭容器中反应达到平衡状态的标志是_______。
①压强不再改变
②生成氨气的速率等于生成氮气的速率
③正反应速率等于零
④容器内气体的平均相对分子量不再改变
⑤单位时间内有3amolH-H的断裂的同时有6amolN-H断裂
查看答案和解析>>
科目: 来源: 题型:
【题目】A 是由两种元素组成的化合物,质量比为 7:8,在真空中加热分解,生成 B、C。E 是常见的液体,C 和E 高温下能发生反应。F 为日常生活中常见的化合物,E、F 之间的反应常用于工业生产,I 为黄绿色气体单质。

(1)写出 A 的化学式:____
(2)写出 K 的电子式:______
(3)写出 C 和 E 高温下能发生反应的方程式:______
(4)写出 D 和 L 发生反应的离子方程式:_______
查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,同时也是对烟气进行脱硫、脱硝的吸收剂。其一种生产工艺如下:

已知:
纯ClO2易分解爆炸,空气中 ClO2的体积分数在 10%以下比较安全;
NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
NaClO2饱和溶液在温度低于 38℃时析出 NaClO23H2O,等于或高于38℃时析出 NaClO2,高于 60℃时分解成 NaClO3和 NaCl。回答下列问题:
(1)写出“反应”步骤中生成 ClO2的化学方程式_________。
(2)从滤液中得到的 NaClO23H2O 晶体的方法是_________。
(3)“尾气吸收”是吸收“电解”过程排出的少量 ClO2 。在尾气吸收过程中,可代替 H2O2的试剂是_________(填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(4)国家标准规定产品中优级纯试剂纯度≥99.8%,分析纯试剂纯度≥99.7%,化学纯试剂纯度≥99.5%。为了确定某批次 NaClO2产品的等级,研究小组设计测定方案如下:取 10.00g 样品,用适量蒸馏水溶解后,加入略过量的 KI 溶液;充分反应后,将反应液定容至 200mL, 取出 20.00mL 于锥形瓶;向锥形瓶中滴加两滴淀粉溶液,用 2.00molL﹣1的 Na2S2O3溶液与之反应,消耗Na2S2O3溶液 22.00mL。该样品可达试剂纯度 ________________。(写出计算过程) 已知: ClO2﹣+4I﹣+4H+═2H2O+2I2+Cl﹣ , I2+2S2O32﹣═2I﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】辉钼矿的主要成分是MoS2(Mo呈+4价),含少量SiO2以及Re的化合物等杂质。由辉钼矿可制得金属缓蚀剂钼酸钠晶体(Na2MoO4·10H2O)、催化剂Mo2C和氧化剂KReO4,其主要流程如下:

(1)焙烧辉钼矿时发生的反应及反应开始的温度(T)与真空度的关系如下图所示:(真空度P/P0表示反应时的压强与标准大气压之比)

为获得碳化钼,在真空度为0.5的条件下,适宜的反应温度应控制___________。
(2)焙烧时,生成Mo2C的反应中被还原的元素有___________(填元素符号);水洗烧结物时,洗去的物质除Na2S、Na2CO3之外,还有___________。
(3)用 NaClO2氧化MoS2时,MoS2转化为MoO42-和SO42-,写出该反应的离子方程式___________。
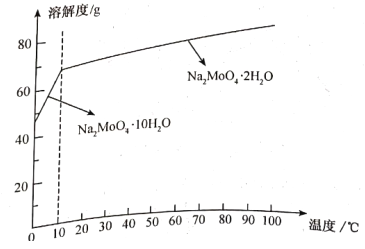
(4)已知钼酸钠的溶解度曲线如下图,获得Na2MoO4·10H2O的操作A为___________、___________、过滤。
(5)生成KReO4晶体的化学方程式为___________;加入KCl时,同时加入乙醇的作用是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学小组同学在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | - | - |

请回答下列问题:
(1)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl制取无水FeCl2并测定FeCl3的转化率。按上图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯。打开K1、K2,关闭K3,通一段时间H2后关闭K2,控制三颈烧瓶内反应温度在128-139℃,反应一段时间。反应完成后打开K2再通氢气一段时间。
①仪器a的名称是______,装置B中盛装的试剂是______。
②反应后再通入H2的目的是______。
③冷却实验装置,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,回收滤液中C6H5Cl的操作方法是______。
④反应后将锥形瓶中溶液配成250mL溶液,取25.00mL所配溶液,用0.4molL-1NaOH溶液滴定,消耗NaOH溶液23.60mL,则氯化铁的转化率为______。
(2)打开K1、K3,关闭K2,通氢气与氯化铁反应制取无水FeCl2。
①写出反应的化学方程式______。
②实验制得FeCl2后并防止氧化的操作是______。
③请指出该制备方法的缺点______。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是温度和压强对X + Y ![]() 2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )

A. 上述可逆反应的正反应为吸热反应
B. X、Y、Z均为气态
C. X和Y是气态,Z为固态
D. 上述反应的逆反应的△H>0
查看答案和解析>>
科目: 来源: 题型:
【题目】在常温常压下,两个容积相同的烧瓶M、N中,分别通入下列4组气体(图和表),当打开A处的夹子使两种气体充分接触后,两烧瓶内的压强由小到大的顺序是______。

组编号 | ① | ② | ③ | ④ |
M中气体 | H2S | H2S | NH3 | NO |
N中气体 | Cl2 | SO2 | HCl | O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com