
科目: 来源: 题型:
【题目】工业上用_______和_______作为原料来制取漂粉精,反应的化学方程式为_______;粉精长期暴露在空气中,会使其失效,主要化学方程式__________;______________________,故其应_______保存。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯碱工厂生产的氯气和氢气可以进一步用于生产盐酸,主要过程如下:

(1)其中关键的一步为氯气和氢气在燃烧管口燃烧生成HCl,氯气有毒,应采取的措施是____。合成盐酸厂要求合成气中的HCl的含量要大于97%,试用最简便的方法进行分析是否含量大于97%____。
(2)氯碱工厂生产的氯气和氢氧化钠溶液可以用于制取“84消毒液”,反应的化学方程式为__。
(3)某同学欲证明盐酸与氯化氢气体性质不同,他分别向A、B、C三支洁净试管中各放入一片干燥的蓝色石蕊试纸,然后往A试管内加入盐酸,试纸显___色,往B试管中通入干燥的氯化氢气体,试纸显___色.最后向C试管中加入物质___(填化学式),他之所以加入这种物质的理由是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上除去SO2尾气有多种方法.
I:烟道气中除去SO2的方法:2CO(g) + SO2(g) 2CO2(g)+ S(l)+Q (Q>0)
(1)该反应的平衡常数表达式为________。若保持其他条件不变,缩小反应容器的体积,平衡常数将会________ (选填“变大”、 “变小”或“不变”) 。
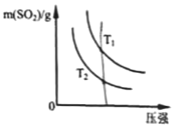
(2)下图是平衡时SO2的质量在不同温度下随压强的变化曲 线,判断: T1________T2 (选填“>”、“<”或“=”)。
(3)若在2L的密闭容器中进行上述反应,经测定在5 min内气体的质量减小了1.6g。则0~5 min的平均反应速率v(CO2)= _________________________________ 。
II:硫酸工业中用氢氧化钠溶液吸收SO2:2NaOH + SO2 → Na2SO3 + H2O, Na2SO3 + SO2 + H2O → 2NaHSO3已知: Na2SO3溶液显碱性,NaHSO3溶液显酸性,两者均易被氧化。
(1)用离子方程式解释Na2SO3溶液显碱性的原因。________________________
(2)若测得某次吸收SO2后的溶液的pH=7 (常温),则该溶液中c(H+)________ c(OH-) (选填“>”、“<”或“=”,下同),c(Na+)________ c(SO3 2-)+c(HSO3-)。上述溶液在空气中放置一段时间后,溶液的pH________7;原因是________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅
C.向氯水中加CaCO3后,溶液漂白性增强
D.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
查看答案和解析>>
科目: 来源: 题型:
【题目】
两名日本科学家与一名美国科学家利用钯作催化剂,将有机物进行“裁剪”、“缝合”,创造出具有特殊功能的新物质而获2010年诺贝尔化学奖。下列说法正确的是( )
A. 有机物中一定含有碳和氢两种元素
B. 一定条件下,使用催化剂能提高反应的平衡转化率
C. 将有机物进行“缝合”可以不遵循原子守恒定律
D. 将有机物进行“裁剪”需要破坏旧的化学键
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在一个密闭容器中进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
查看答案和解析>>
科目: 来源: 题型:
【题目】氢元素与其他元素形成的二元化合物称为氢化物,有关氢化物的叙述正确的是
A. HF的电子式为![]() B. H2O的空间构型为直线型
B. H2O的空间构型为直线型
C. NH3的结构式为![]() D. CH4的比例模型为
D. CH4的比例模型为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。

请回答下列问题:
(1)在“图1”中,曲线____填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g)![]() CH3OH(g)的△H= _________________________ 。
CH3OH(g)的△H= _________________________ 。
(2)下列说法正确的是 (_________)
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,υ(CO)= _______;达到平衡时,c(H2)= ____ ,该温度下CO(g)+2H2(g) ![]() CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图,将潮湿的![]() 通过甲装置后再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂不可能是
通过甲装置后再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂不可能是
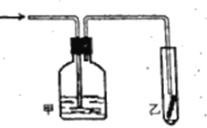
A.饱和食盐水B.浓硫酸C.KI溶液D.NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com