
科目: 来源: 题型:
【题目】某化学兴是小组对一种度旧合金(含有Cu、Fe、Si等元素)进行分离、回收利用,所设计工艺流程如下。
已知298℃时,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13,当离子浓度小于1×10-5认为离子沉淀完全。
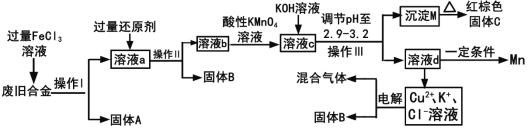
回答下列问题:
(1)操作I、lI、III为_______,固体A是__________(填化学式)。
(2)加入过量FeC13溶液过程中与较不活泼的金属反应的化学方程式_______。
(3)调节pH至2.9--3.2的目的___________________。
(4)①向溶液b中加入酸性KMn04溶液发生反应的离子方程式为_________________。
②若将溶液b配制成250ml溶液,用滴定管取配制后的溶液25.00m1;再用amol/LKMnO4溶液滴定,恰好反应时消耗KMn04溶液VmL,则流程图中所得红棕色固体C的质量为___g(用含a、v的代数式表示)
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后沉淀的金属离子为____________(填金属阳离子)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题意回答下列问题(填字母)
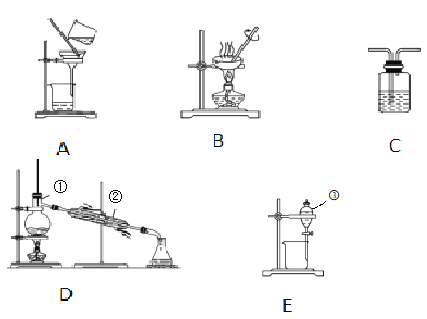
(1)写出上图中序号①~③仪器的名称:
①____②____③____。
(2)分离Na2CO3溶液和CH3COOC2H5(液体,难溶于水):选___,操作名称为___。
(3)用CCl4提取碘水中的碘,选____,操作名称为___。
(4)粗盐提纯,选____,操作名称为____。
(5)石油中得到汽油和煤油,选____,操作名称为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿
是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿![]() 主要成分
主要成分![]() ,还有
,还有![]() 、
、![]() 、
、![]() 等
等![]() 作脱硫剂,通过如下简化流程既脱除燃煤尾气中的
作脱硫剂,通过如下简化流程既脱除燃煤尾气中的![]() ,又制得
,又制得![]() 反应条件已经省略
反应条件已经省略![]() 。
。
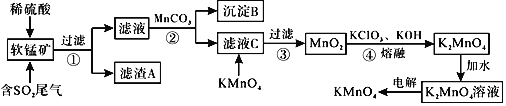
已知:![]() ,
,![]() 回答下列问题:
回答下列问题:
![]() 滤渣A的成分是
滤渣A的成分是![]() 写化学式
写化学式![]() ______。
______。
![]() 析出沉淀B时,首先析出的物质是
析出沉淀B时,首先析出的物质是![]() 写化学式
写化学式![]() ______。
______。
![]() 步骤2中加入
步骤2中加入![]() 的作用为______。
的作用为______。
![]() 滤液C中加入
滤液C中加入![]() 时发生反应的离子方程式是______。
时发生反应的离子方程式是______。
![]() 完成步骤4中反应的化学方程式______
完成步骤4中反应的化学方程式______![]() ______
______![]() ______
______![]() ______
______
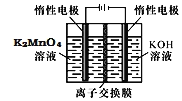
![]() 电解制备
电解制备![]() 的装置如图所示。电解液中最好选择______离子交换膜
的装置如图所示。电解液中最好选择______离子交换膜![]() 填“阳”或“阴”
填“阳”或“阴”![]() 。电解时,阳极的电极反应式为______。
。电解时,阳极的电极反应式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】叠氮化钠(NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。
已知:①NaNH2+N2O![]() NaN3+H2O。
NaN3+H2O。
②NaNH2能与水反应生成NaOH和NH3
实验室利用如下装置模拟工业级NaN3的制备。
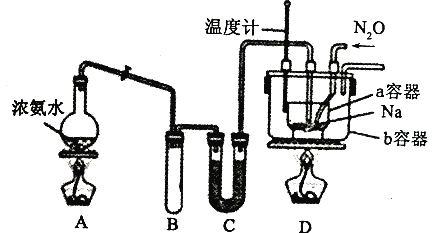
请回答下列问题:
实验I:制备NaN3
(1)装置C中盛放的药品为______________________;
(2)为了使反应均匀受热,装置D处b容器应采取的加热方式为______________________。
(3)实验开始时首先应加热通氨气,其目的是___________。
(4)氨气与熔化的钠反应生成NaNH2的化学方程式为___________。
实验Ⅱ:分离提纯
反应完全结束后,取出装置D中的混合物进行以下操作,得到NaN3固体。
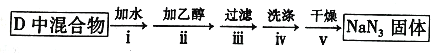
(5)操作ⅳ采用乙醚洗涤的原因是______________________(答一项即可)。
实验Ⅲ:定量测定
实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:
①将2.500g试样配成500mL溶液
②取50.00L溶液置于锥形瓶中,加入50.00mL0.1010m1·L-1(NH4)2Ce(NO3)6溶液。
③充分反应后,将溶液稍稀释,向溶液中加入8.00mL浓硫酸,滴人3滴邻菲啰啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑, Ce4++Fe2+=Ce3++Fe3+。
(6)配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有______________________。
(7)若其它读数正确,滴定到终点后,读取滴定管中(NH4)2Fe(SO4)2标准溶液体积时俯视,将导致所测定样品中叠氮化钠质量分数___________(选填“偏大”、“偏小”或“不变”)。
(8)减样中NaN3的质量分数为___________ (保留四位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组用重铬酸钾测定土壤中的有机质,其反应原理可简化为:2K2Cr2O7+ 3C + 8H2SO4→2Cr2(SO4)3+ 2K2SO4 + 3CO2↑+8H2O
(1)上述反应涉及的元素中,非金属性最强的是________,硫原子核外有________种运动状态的电子。
(2)干冰属于________晶体,该晶体中存在的作用力有________、________。
(3)该反应的氧化剂是________;标准状况下每生成2.24 L CO2转移________个电子。
(4)有小组成员用盐酸代替硫酸进行实验,发现产生了黄绿色气体,该气体为________。产生该气体的原因是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高温、催化剂条件下,某反应达到平衡,平衡常数K=c(CO)·c(H2O)/c(CO2)·c(H2)恒容时,温度升高,H2浓度减小.下列说法正确的是
A. 该反应的焓变为负值
B. 升高温度,正反应速率增大,逆反应速率减小,平衡正向移动
C. 2CO2(g)+2H2(g)2CO(g)+2H2O(g) 的平衡常数K1=K2
D. 若恒容、恒温下充入CO,则K值变大
查看答案和解析>>
科目: 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4A(s)+3B(g)=2C(g)+D(g),经2 min后,B的浓度减少了0.6mol/L。下列反应速率的表示正确的是
A. 用A表示的反应速率是0.4 mol/(L·min)
B. 用C表示的反应速率是0.2 mol/(L·min)
C. 2 min末时的反应速率,用B表示是0.3 mol/(L·min)
D. 在这2 min内用B表示的反应速率的值是减小的,C表示的反应速率逐渐增大
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上合成乳酸(![]() )的一种途径如下:
)的一种途径如下:
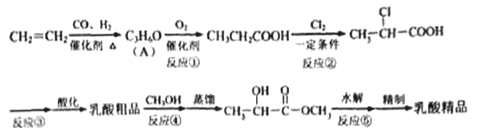
完成下列填空:
(1) 乳酸中的官能团名称是___________ 。A 的结构简式是___________。
(2)反应②的反应类型是___________。反应③的条件是___________。
(3)反应④的化学方程式为____________________________________________。
(4)聚乳酸是一种常用的可降解塑料,由乳酸聚合得到,其结构如下:
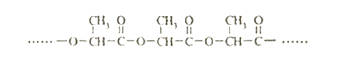
聚乳酸降解时,会产生自催化效应(降解的速度会越来越快) ,请解释原因__________。
(5)设计一条由丙烯制备丙酸的合成路线 _____________________ 。
(合成路线常用的表示方式为:A ![]() B ... ...
B ... ... ![]() 目标产物)
目标产物)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com