
科目: 来源: 题型:
【题目】请回答与 HCl 的实验室制法和性质探究的相关问题:
(1)实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体,反应的化学方程式为___________。
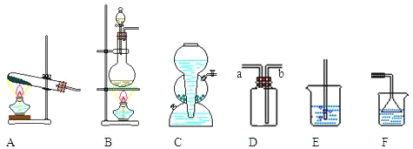
(2)氯化氢气体的发生装置应该选择图中的_______(填装置的编号,下同)。实验室常用装置D来收集氯化氢,则收集氯化氢时,气体从_____管(填a或b)进入。用水吸收多余的氯化氢气体时,可以选择装置_____。
(3)某同学欲证明盐酸与氯化氢气体性质不同,他向A、B、C 三支洁净试管里各放一片干燥的蓝色石蕊试纸,然后向A试管里加入盐酸,试纸显_____色;往B试管中通入干燥的氯化氢气体,试纸显_____色。 这时他认为由此还不能得出满意的结论,于是向C试管中加入化学式为_______的物质,目的是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为___________________________________________。
(2)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为__________________________________。
(3)比较下列各组热化学方程式中ΔH的大小关系。
4Al(s)+3O2(g) = 2Al2O3(s) ΔH1
4Fe(s)+3O2(g) = 2Fe2O3(s) ΔH2
ΔH1______ΔH2
(4)已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
若某反应的平衡常数表达式为K=[c(N2)·c2(CO2)]/[c2(CO)·c2(NO)],请写出此反应的热化学方程式:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学活动小组查阅资料发现,粗盐中除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,他们要除去杂质得到精盐,设计了下列实验流程图(序号①~⑧表示实验操作,用于沉淀的试剂稍过量)

根据上述流程,回答下列问题:
(1)操作①中玻璃棒的作用是_________;
(2)第⑤步操作的名称是_________;
(3)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、酒精灯和_______;
(4)实验中加入Na2CO3溶液的目的是___________;
(5)利用提供的沉淀试剂,再写出一种添加上述 4 种试剂的操作顺序(填序号)_________;
(6)分别写出步骤②③④中发生反应的化学方程式。②_________、③____________、④____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】太阳能电池可分为:硅太阳能电池,化合物太阳能电池,如砷化镓(GaAs)、铜铟镓硒(CIGS)、硫化镉(CdS),功能高分子太阳能电池等,Al-Ni常作电极。据此回答问题:
(1)镍(Ni)在周期表中的位置为______;S原子的价电子排布式为________;Ga、As和Se的第一电离能由大到小的顺序是________。
(2)Na3As3中As原子的杂化方式为_____;AsCl3的空间构型为____。
(3)GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为__________。
(4)写出一种与SO42-互为等电子体的分子_________。
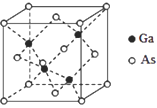
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为_____。已知GaAs的密度为ρg/cm3,Ga和As的摩尔质量分别为 MGa g/mol和MAsg/mol,则GaAs晶胞中Ga之间的最短距离为________pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】某微粒的结构示意图为![]() ,试回答:
,试回答:
(1)x表示______,y和微粒的电子层数共同决定了该微粒的________。
(2)当x-y=10时,微粒为_________(填微粒类别)。
(3)y=8时,该微粒带2 个单位负电荷,则该微粒的符号为_______,该微粒的结构示意图为_________。
(4)当y=1的中性原子M与y=7的中性原子N 化合时,形成的化合物的化学式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,向2L密闭容器中加入2molX、1molY。发生如下反应:2X(g)+Y(?) ![]() 3Z(g) H<0。经60s达平衡,此时Y的物质的量为0.2mol。下列说法正确的是
3Z(g) H<0。经60s达平衡,此时Y的物质的量为0.2mol。下列说法正确的是
A. 反应开始至平衡时,用X表示的化学反应速率为1.2 mol/(L·min)
B. 该反应平衡常数表达式一定是K=c3(Z)/[c2(X)c(Y)]
C. 若再充入1 mol Z,重新达平衡时X的体积分数一定增大
D. 若使容器体积变为1 L,Z的物质的量浓度一定增大
查看答案和解析>>
科目: 来源: 题型:
【题目】已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO45H2O(s)═CuSO4(s)+5H2O(l)△H=+Q2kJmol-1则Q1、Q2的关系为
A. Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q kJ |
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 平衡时,两容器中CO2的浓度相等
D. 容器①时CO的反应速率等于H2O的反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】已知298K时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子[-lgc(M2+)]与溶液pH的变化关系如a、b所示,已知:该温度下Kap[Cu(OH)2]<Kap[Fe(OH)2]下列说法中正确的是
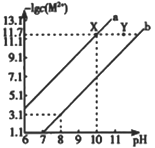
A. a线表示Fe(OH)2饱和溶液中的变化关系
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6:1
C. 除去CuSO4溶液中少量的Fe2+,可加入适量CuO
D. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com