
科目: 来源: 题型:
【题目】I. 工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJmol-1
CH3OH(g)+H2O(g) △H=-49.0kJmol-1
将6mol CO2和8mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
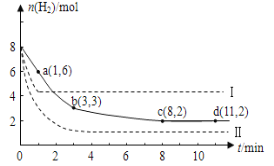
(1)b点正反应速率 ___________(填“大于”“等于”或“小于”)逆反应速率。
(2)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中所示(虚线)。曲线I对应的实验条件改变是______________, 体积不变再充入3mol CO2和4mol H2,达到新的平衡时,CH3OH (g)的体积分数 ___________(填“增大”“不变”或“减小”)。
(3)若将1mol CO2和3mol H2充入该容器中,充分反应达到平衡后,若CO2转化率为a,假设温度不变, 则容器内的压强与起始压强之比为 _________________(用a表示)。
Ⅱ. 工业上还可在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(4)在一定温度下,若将4amol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为_____________。若此时再向该容器中投入amol CO、2amol H2和amol CH3OH,判断平衡移动的方向是__________(“正向移动”“逆向移动”或“不移动”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有 A、B、C三种元素,其中 A、C两元素能形成化合物 AC。已知 B和 C原子的核外电子层数相同,且最外层电子数之和为10,A2+和B原子具有相同的电子层数。C原子最外层电子数为次外层电子数的3倍,请回答以下问题:
(1)A、B、C三种元素的名称分别是:A________、B________、C_______。
(2)写出 A离子的结构示意图__________。
(3)化合物 AC中存在的化学键为_______键,写出 AC 的电子式____________。
(4)写出化合物BC2的结构式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 0.3mol·L-1A1(NO3)3溶液中含A13+数小于0.3NA
B. H2(g)+I2(g)![]() 2HI(g) △H=-akJ·mol-1,若向某密闭容器中加入NA个氢分子和NA个碘分子,则充分反应后放出的热量为akJ
2HI(g) △H=-akJ·mol-1,若向某密闭容器中加入NA个氢分子和NA个碘分子,则充分反应后放出的热量为akJ
C. 标准状况下,(-)Zn│H2SO4(1mol·L-1)│Cu(+)原电池中,当正极产生1.12LH2时,则外电路中通过的电子数为0.1NA
D. 常温常压下,28 g C2H4和CO的混合气体中含有碳原子的数目为1.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.18 g冰水混合物中有NA个原子和10NA个电子
B.常温常压下16 g 氧气和臭氧混合气体含有NA个氧原子
C.标准状况下,33.6 L水含有1.5NA个水分子
D.2.24 L二氧化碳中含有0.3NA个原子
查看答案和解析>>
科目: 来源: 题型:
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10
③当某物质浓度小于1.0×10-5mol·L-1时,视为完全沉淀。
(1)请写出一种能提高“酸浸”速率的措施:_________________________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式______________.
(3)pH的调控范围为__________,
(4)写出“沉钙”时的离子反应方程式:_________________________________。当Ca2+沉淀完全时,溶液中F-浓度的最小值为___________mol·L-1(写出计算式即可)。证明Ni2+已经沉淀完全的实验操作及现象是_________。
(5)操作a的内容是___________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】运用已学知识完成下列计算:
(1)17gNH3共有______mol原子,0.1molH2S共有_____个氢原子;同质量的NH3和H2S中分子个数比为_______。
(2)在标准状况下,1.7g氨气所占的体积为_____L,它与标准状况下_____L的硫化氢(H2S)含有相同数目的氢原子。
(3)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mgmol-1。若阿伏加德罗常数用NA表示,则该气体的物质的量为_____mol,该气体所含原子总数为______个,在标准状况下该气体的体积为________L。若该气体不与水反应,将其溶于1L水中,所得溶液中溶质的质量分数为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气和燃煤尾气是造成空气污染的重要原因之一,治理汽车尾气和燃煤尾气是环境保护的重要课题。回答下列问题:
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:
①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②N2(g)+2O2(g)= 2NO2(g) △H=+67.8 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
则CH4催化还原NO的热化学方程式为__________________________________。
(2)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。

①据此判断该反应的正反应为____(填“放热”或“吸热”)反应。
②温度T1时,该反应的平衡常数K=_____;反应速率v=v正-v逆=k正c2(NO)c2(CO)-k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处![]() =________。
=________。
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素作还原剂,其基本流程如图:
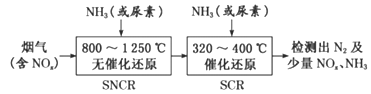
①SNCR-SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0,则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为____________。
②体系温度直接影响SNCR技术的脱硝效率,如图所示:
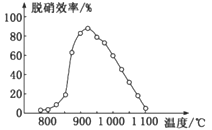
SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是__________;当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(1)ΔH=-57.3kJ·mol-1、计算下列中和反应放出的热量
(1)用20g NaOH配成的稀溶液跟足量的稀盐酸反应,能放出___________kJ的热量
(2)用1mol醋酸稀溶液和足量的NaOH稀溶液反应,放出的热量 __________57.3kJ(填 “>”、“<”、或“=”)理由是______________________________________ 。
(3)1L0.1mol/L NaOH溶液分别与①醋酸溶液;②浓硫酸;③稀硝酸恰好反应时,放出的热量分别为Q1、Q2、Q3(单位kJ)。则它们由大到小的顺序为 _______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com