
科目: 来源: 题型:
【题目】下列图像不符合反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH<0 的是(图中v是速率,φ为混合物中H2的体积百分含量)( )
FeO(s)+H2(g) ΔH<0 的是(图中v是速率,φ为混合物中H2的体积百分含量)( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下向10mL0.1mol/LKOH溶液中加入0.1mol/L的一元酸HX,溶液pH的变化曲线如图所示。下列说法正确的是( )

A. a、b两点对应的溶液中水电离出的氢离子浓度:a>b
B. a点对应的溶液中存在:c(K+)>c(X-)>c(H+)>c(HX)
C. 当溶液pH=7时,c(K+)=c(X-)+c(HX)
D. b点对应的溶液中c(X-)< c(HX)
查看答案和解析>>
科目: 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6 g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入22.4 L的CO
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色)△H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )
N2O4(无色)△H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )

A. b点达到平衡状态
B. b点与a点相比,c(NO2)、c(N2O4)均减小
C. d点:v(正)<v(逆)
D. 若在c点将温度降低,其透光率将增大
查看答案和解析>>
科目: 来源: 题型:
【题目】在同温同压下,在两个容积相同的容器中,一个盛有CO气体,另一个盛有CO2气体,则两容器内的气体一定具有相同的
A.密度 B.原子数 C.质量 D.分子数
查看答案和解析>>
科目: 来源: 题型:
【题目】传统接触法制取硫酸能耗大,污染严将燃料电池引人硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。
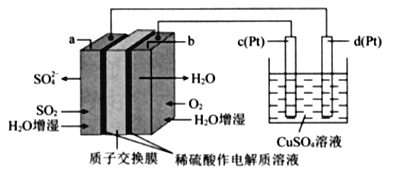
下列说法不正确的是( )
A. b极为正极,电极反应式为O2+4H++4e-=2H20
B. H+由a极通过质子交换膜向b极移动
C. 该燃料电池的总反应式为2SO2+O2+2H2O=2H2SO4
D. 若a极消耗2.24 L(标准状况)SO2,理论上c极,有6.4g铜析出
查看答案和解析>>
科目: 来源: 题型:
【题目】浓度均为1 mol/L KCl、CuCl2、AlCl3三种溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3︰2︰1时,所用KCl、CuCl2、AlCl3三种溶液的体积比为( )
A. 9︰6︰2 B. 9︰3︰1 C. 6︰3︰2 D. 6︰3︰1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定质量的液态化合物AB2与标准状况下一定质量的O2恰好完全反应,化学方程式为 ,冷却后,在标准状况下测得生成物的总体积是336mL,密度为2.56gL-1。
,冷却后,在标准状况下测得生成物的总体积是336mL,密度为2.56gL-1。
①反应前![]() 的体积为_____。
的体积为_____。
②化合物AB2的摩尔质量为____。
③若AB2分子中A、B两元素的质量之比是3:16,则A、B两元素分别为____(填元素符号,下同)、_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】相同质量的SO2和SO3,它们之间的关系正确的是
A.所含硫原子的物质的量之比为1:1
B.所含硫元素的质量比为5:4
C.所含氧元素的质量比为4:5
D.所含氧原子的物质的量之比为3:2
查看答案和解析>>
科目: 来源: 题型:
【题目】工业合成氨反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH = — 92.0kJ·mol-1,恒容时,体系中各物质浓度随时间变化曲线如图所示,下列说法正确的是( )
2NH3(g) ΔH = — 92.0kJ·mol-1,恒容时,体系中各物质浓度随时间变化曲线如图所示,下列说法正确的是( )

A. 25min时采取的措施是降低温度或增大压强
B. 将0.5 mol氮气、1.5 mol氢气置于1 L密闭容器中发生反应,放出的热量为46 kJ
C. Ⅰ、Ⅱ、Ⅲ 三个时间段分别是改变一个条件引起的平衡移动,平衡时平衡常数:KⅢ > KⅠ = KⅡ
D. 为了增大合成氨的产率可以通过使用催化剂、原料的循环使用来实现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com