
科目: 来源: 题型:
【题目】一定量的氢气在氯气中燃烧,所得混合物用200mL 3.00mol∕L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.15mol。(忽略溶液体积的变化)
(1)求原NaOH溶液的质量分数(保留两位小数);___________
(2)所得溶液Cl-中的物质的量浓度;__________
(3)所用氯气和参加反应的氢气的物质的量之比。_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】电解饱和食盐水是氯碱工业的基础,下图是实验室中电解饱和食盐水的装置图,A、B均为石墨电极,U形管内装有足量的饱和食盐水,通电几分 钟后,将湿润的淀粉碘化钾试纸放在A电极一端的管口,试纸变蓝色,请回答:
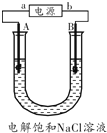
(1)b端为电源的_______极;请用化学方程式解释使湿润的淀粉淀化钾试纸变蓝的原因_____________
(2)写出B极的电极反应式_______
(3)若在U形管的两端分别滴加无色酚酞溶液,则一段时间后_____极(填“A”或“B”)呈红色
(4)请写出电解饱和食盐水的化学方程式_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】某芳香烃A可以从煤干馏得到的煤焦油中分离出来,以A为原料可以合成聚邻氨基苯甲酸、扁桃酸等物质,其合成流程如下(部分产物、合成路线、反应条件已略去):
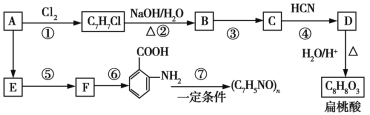
已知:
Ⅰ.R—CHO+HCN![]()
![]()
Ⅱ.R—CN![]() R—COOH
R—COOH
Ⅲ.![]()
![]()
![]() (苯胺易被氧化)
(苯胺易被氧化)
请回答下列问题:
(1)C的分子式为__________。
(2)下列对相关反应类型的判断合理的是__________ (填序号)。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
Ⅰ | 加成 | 水解 | 还原 | 取代 | 还原 | 氧化 | 加聚 |
Ⅱ | 加成 | 消去 | 还原 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅲ | 取代 | 水解 | 加成 | 氧化 | 还原 | 缩聚 | |
Ⅳ | 取代 | 消去 | 氧化 | 取代 | 还原 | 氧化 | 加聚 |
(3)写出反应③的化学方程式:______________________________。
(4)扁桃酸有多种同分异构体,其中既能与氯化铁溶液发生显色反应,又能与碳酸氢钠溶液反应产生气泡的同分异构体有__________种,写出其中一种的结构简式:__________________。
(5)以芳香烃A为主要原料,还可以通过下列合成路线合成阿司匹林和冬青油:

①冬青油的结构简式为____________________。
②写出反应Ⅴ的化学方程式:______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】右图的装置中,干燥烧瓶中盛有某种气体,烧杯和胶头滴管内盛装某种溶液。挤压胶头滴管的胶头,下列与实验事实不相符的是

A.CO2(饱和NaHCO3溶液)无色喷泉
B.NO2(H2O含石蕊)红色喷泉
C.NH3(H2O含石蕊)蓝色喷泉
D.HCl(AgNO3溶液)白色喷泉
查看答案和解析>>
科目: 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
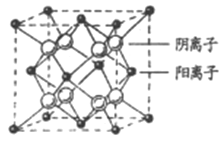
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如上图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为_____________。
(2)“酸浸”后,钛主要以![]() 形式存在,写出相应反应的离子方程式________。
形式存在,写出相应反应的离子方程式________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:

分析40 ℃时TiO2·xH2O转化率最高的原因________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为_______。
(5)若“滤液②”中![]() ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使![]() 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中![]() ,此时是否有
,此时是否有![]() 沉淀生成? ________(列式计算)。
沉淀生成? ________(列式计算)。![]() 的Ksp分别为
的Ksp分别为![]()
(6)写出“高温煅烧②”中由![]() 制备
制备![]() 的化学方程式___________。
的化学方程式___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积为2L的密闭容器中,发生如下反应:N2+ 3H2 ![]() 2NH3。
2NH3。
(1)若反应进行5min时,测得n(N2) = 1.8mol,n(NH3) = 0.4mol。
计算:①a的值; ②用H2浓度的变化表示的反应速率。
(2)反应达平衡时,混合气体的总物质的量为5.0mol,其中NH3的含量(体积分数)为40%。
计算:上述温度下该反应的化学平衡常数。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂的作用下转化为单质S。已知:
①CO(g)+0.5O2(g)![]() CO2(g) ΔH=-283.0kJ·mol-1
CO2(g) ΔH=-283.0kJ·mol-1
②S(s)+O2(g)![]() SO2(g) ΔH=-296.0kJ·mol-1
SO2(g) ΔH=-296.0kJ·mol-1
则处理CO、SO2的方法的热化学方程式是________________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)![]() NO(g)+CO2(g) ΔH=-a kJ·mol-1 (a>0)
NO(g)+CO2(g) ΔH=-a kJ·mol-1 (a>0)
2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO将NO2还原至N2(CO完全反应),则整个过程中转移电子的物质的量为______mol,放出的热量为_____(用含有a和b的代数式表示)kJ。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ①
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ①
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH2 ②
2N2(g)+CO2(g)+2H2O(g) ΔH2 ②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=_______。
(4)已知下列热化学方程式:
①H2(g)+0.5O2(g)![]() H2O(l) △H=-285.8 kJ·mol-1
H2O(l) △H=-285.8 kJ·mol-1
②H2(g)+0.5O2(g)![]() H2O(g) △H=-241.8 kJ·mol-1
H2O(g) △H=-241.8 kJ·mol-1
则H2的燃烧热(△H)为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)===N2(g)+2CO2(g),请回答下列问题:
(1)已知:N2(g)+O2(g)===2NO(g) ΔH=+180.5kJ·mol1
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol1
2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol1
则2NO(g)+2CO(g)===N2(g)+2CO2(g)的ΔH=____________kJ·mol1。
(2)一定温度下,向容积为1L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=0.1mol,n(NO)=0.2mol,n(N2)=a mol,且平衡时混合气体压强为初始气体压强的0.8。
①则该反应的平衡常数K=____________。若保持温度及容器容积不变,平衡后在此基础上再向容器中充入2a mol的N2、0.2mol的NO,平衡将____________(填“向左”“向右”或“不”)移动。
②下列各种情况,可说明该反应已经达到平衡状态的是____________(填字母)。
A.v(CO2)生成=v(CO)消耗
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n mol N≡N
③在t2时刻,改变某一外界条件,正反应速率的变化曲线如图所示:可能改变的条件是____________、_________。

(3)有人提出可以用如图所示的电解原理的方法消除汽车尾气,写出阳极发生的电极反应式:________________________________________。
(4)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采用的措施是__________。
A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com