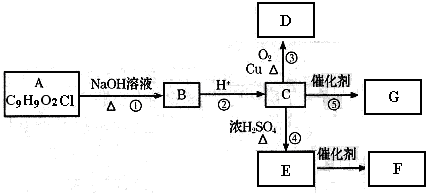
某溶液含有下表离子中的几种(不考虑水的电离及离子的水解).溶液中阴离子物质的量为0.2mol,阳离子物质的量为0.3mol,阳离子只有两种.
| 阳离子 |
Ba2+ NH4+ Fe3+ Al3+ Fe2+ |
| 阴离子 |
OH- CO32- Cl- SO32- SO42- |
①若向原溶液中加入过量稀盐酸,无气体生成,得到溶液A.
②向溶液A中加入过量稀HNO
3,再加AgNO
3溶液,溶液中析出白色沉淀.过滤,得滤液B.
③往B中加入过量NaOH溶液并加热,有4.48L刺激性气味气体产生(不考虑气体溶解于水或与水反应,体积已折算为标准状况下的体积),同时有红褐色沉淀生成.过滤,得滤液C,此过程中沉淀的量不减少.
④若向原溶液中加入稀HNO
3,再加足量BaCl
2,有46.6g白色沉淀生成.
根据上述实验回答下列问题.
(1)原溶液中一定不存在的阴离子是
OH-、CO32-、Cl-、SO32-
OH-、CO32-、Cl-、SO32-
.
(2)写出③总的离子方程式
2NH
4++Fe
3++5OH
-2NH
3↑+Fe(OH)
3↓+2H
2O
2NH
4++Fe
3++5OH
-2NH
3↑+Fe(OH)
3↓+2H
2O
.
(3)若原溶液由一种盐溶解于水制得,则该盐的化学式为
(NH4)2Fe(SO4)2
(NH4)2Fe(SO4)2
.
(4)若原溶液由R和M(摩尔质量R>M)两种盐溶解于水制得,则这两种盐的化学式为
(NH4)2SO4和FeSO4
(NH4)2SO4和FeSO4
,其物质的量之比为
1:1
1:1
.
ⅰ、M溶液中各离子浓度由大到小的顺序为
c(NH4+)>c(SO42-)>c(H+)>c(OH-)
c(NH4+)>c(SO42-)>c(H+)>c(OH-)
.
ⅱ、实验室用工业废料制备盐R,在利用重结晶方法精制该盐时,需要趁热过滤,原因是
为减少过滤时该盐的损失
为减少过滤时该盐的损失
.


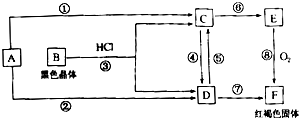 已知A为常见的金属单质,根据图示的关系,回答下列问题.
已知A为常见的金属单质,根据图示的关系,回答下列问题.