
科目: 来源: 题型:
【题目】某废旧锂电池材料含有钴酸锂(LiCoO2)、导电剂石墨和铝粉等。回收废旧锂电池中钴的工艺流程如下:
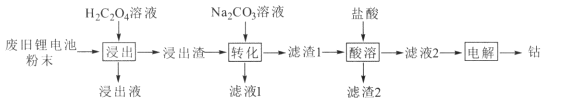
已知:Ksp(CoC2O4)=2.5×10-9,Ksp(CoCO3)=1.5×10-13
回答下列问题:
(1)“浸出液”的主要成分是LiHC2O4、Al(HC2O4)3,“浸出渣”的主要成分是CoC2O4。“浸出”中生成CoC2O4的化学方程式为 _______ ,若H2C2O4用量过大,CoC2O4的产率反而会降低,原因是____。
(2)“转化”中加入Na2CO3溶液发生反应的离子方程式为___________,该反应进行的程度较大,试用平衡常数K解释原因 _____ 。
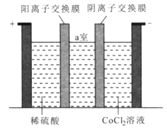
(3)“电解”时装置如图所示。阳极的电极反应式为______,电解后a室中的电解液可返回 ________工序继续使用。
(4)某废旧锂电池粉末中LiCoO2的质量分数为w,将mkg该废料进行回收利用,电解得到钴nkg,钴的回收率为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】小王同学准备用CuSO4·5H2O配制490 mL 0.1 mol/L的溶液。
(1)小王同学选用的玻璃仪器有:烧杯,玻璃棒,胶头滴管,___。
(2)玻璃棒在该实验中有重要的用途,分别是___和____;
(3)小王同学通过计算,用托盘天平称取___g CuSO4·5H2O。
(4)物质的量浓度误差(填偏高、偏低、无影响)
A.若容量瓶洗净后未干燥,其中残留少量水,则所配制的溶液浓度将_____;
B.定容时,若眼睛俯视,则所配制的溶液浓度将_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有部分短周期(即原子序数为1~18号)元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上的电子数等于其内层电子数的差值 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下其单质为双原子分子,且占空气中的含量最大 |
Z | 该元素的某种含氧酸具有漂白性 |
(1)按要求用有关的化学用语填充:
T元素的离子符号:______;Y离子的电子式__________;Z离子的结构示意图_______________;
(2)元素Y与氢元素能形成一种10电子的阳离子,该微粒符号是____________;
(3)写出元素T的最高价含氧酸与X的最高价含氧酸对应的钠盐反应的化学方程式____
(4)元素Z与某一活泼金属元素组成的盐是重要的化工原料,写出其作为该原料在化工生产上电解的一个重要反应:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】POC13是重要的化工原料,某兴趣小组准备用三氯化磷、氯气、二氧化硫制备POC13,产物中还有一种遇水强烈水解的物质SOC12。

已知:PC13熔点-93.6℃、沸点76.1℃,遇水强烈水解,易与氧气反应;POC13遇水强烈水解,能溶于PC13.
(1)仪器甲的名称是________________。
(2)已知装置B制备POC13,以上仪器接口连接的顺序为a____d,装置B中发生反应的化学方程式为_________________________。
(3)B中反应温度控制在60~65℃,其原因是__________________________。
(4)用佛尔哈德法测定POC13含量:准确称取20.20g POC13产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;加入10.00mL 3.200mol·L-1AgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;加入指示剂,用0.2000mol·L-1KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00mL KSCN溶液。
(已知:KSP(AgC1)=3.2×10-10,KSP(AgSCN)=2×10-12)
①POC13水解的化学反应方程式为______________________________。
②滴定选用的指示剂是__________(选填字母),滴定终点的现象为__________。
a.FeC12 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
③用硝基苯覆盖沉淀的目的是___________________________________。
④产品中POC13的百分含量为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(化学——选修5:有机化学基础)
合成抗癌新药盐酸埃克替尼的关键中间体G的一种合成路线如下图:
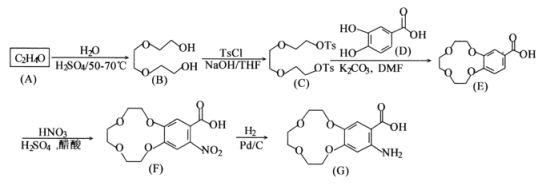
已知:①A分子中只有一种化学环境的氢;
②TsCl为![]()
(1)A的结构简式为__________________。
(2)E的分子式为_____________;G中的含氧官能团的名称有___________。
(3)由E生成F的反应类型是________________。
(4)W是D的同分异构体.W是三取代芳香族化合物,既能发生银镜反应和水解反应,又能与FeC13溶液发生显色反应;1mol W最多可与4mol NaOH反应,W的同分异构体有______种;若W的核磁共振氢谱只有4组峰.则W的结构简式为:_____________。
(5)参照上述合成路线,以(![]() )和邻苯二酚为原料(其它试剂任选),设计制备的
)和邻苯二酚为原料(其它试剂任选),设计制备的 合成路线。_____________________________________
合成路线。_____________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入NH3 0.4 mol,甲室中充入HCl和N2的混合气体,静止时隔板位置如图所示。已知甲、乙两室中气体的质量差为17.3g,则甲室中HCl和N2的物质的量之比为( )

A.1∶3B.1∶4C.3∶1D.4∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g) ![]() H2NCOONH4(s) △H=-272KJ·mol-1
H2NCOONH4(s) △H=-272KJ·mol-1
第二步:H2NCOONH4(s) ![]() CO(NH2)2(s)+H2O(g) △H=+138kJ·mol-1
CO(NH2)2(s)+H2O(g) △H=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:______________________。
(2)一定温度下,向2L恒容密闭容器中通入2molCO和1mol SO2,发生反应2CO(g)+SO2(g) ![]() 2CO2(g)+S(s)。若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=_________,该温度下反应化学平衡常数K=__________。
2CO2(g)+S(s)。若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=_________,该温度下反应化学平衡常数K=__________。

(3)工业上可用NaC1O碱性溶液或“亚硫酸盐法”吸收SO2。
①为了提高吸收效率,常用Ni2O3作为催化剂。催化过程如图所示:
a.过程2的离子方程式_______________________________。
b.Ca(C1O)2也可用于脱硫,且脱硫效果比NaC1O更好,原因是________________。
②室温条件下,将烟气通入(NH4)2SO4溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示,b点时溶液pH=7,则n(NH4+):n(SO32-)=__________。
(4)用食盐水做电解液电解烟气脱氮的原理如图,NO被阳极产生的氧化性物质氧化为NO3-,尾气经氢氧化钠溶液吸收后排入空气。如下图,电流密度和溶液pH对烟气脱硝的影响。

①NO被阳极产生的氧化性物质氧化为NO3-反应的离子方程式___________________。
②溶液的pH对NO去除率影响的原因是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )

A. b电极是阴极B. a电极与电源的正极相连
C. 电解过程中水是氧化剂D. b电极附近溶液的pH变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com