
科目: 来源: 题型:
【题目】联合国宣布2019年为“国际化学元素周期表年”。元素W、X、Y和Z在周期表中的相对位置如图所示,其中元素Z位于第四周期,W、X、Y原子的最外层电子数之和为 18。下列说法正确的是

A. 简单氢化物沸点:Y>WB. 原子半径:Z>Y>X
C. 氧化物的水化物的酸性:W<XD. 推测Z是半导体材料,Z与Y可形成化合物ZY4
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用乙苯![]() 经催化脱氢生产苯乙烯
经催化脱氢生产苯乙烯![]() ,下列说法错误的是
,下列说法错误的是
A. 乙苯可通过石油催化重整获得
B. 乙苯的同分异构体超过四种
C. 苯乙烯与氯化氢反应可生成氯代苯乙烯
D. 乙苯和苯乙烯分子所有碳原子均可处于同一平面
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
S | 112.8 | 444.6 | 略 |
S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S;与过量氯气发生S2Cl2+Cl2 温度超300℃以上完全分解为硫和氯气 |
设计实验装置图如下:

(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见_______________________。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式为_________________________________________________________。
(3)C、D中的试剂分别是_________________、_____________________。
(4)仪器A、B的名称分别是___________、___________,F的作用是_______________________。
(5)如果在加热E时温度过高,对实验结果的影响_________________________________;在F中可能出现的现象是________________________________________________。
(6)S2Cl2粗品中可能混有的杂质是(填写两种物质的化学式)______________、_____________,为了提高S2Cl2的纯度,关键的操作是控制好温度和_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A2![]() 可将B2-氧化为B单质,
可将B2-氧化为B单质,![]() 则被还原为A3+,又知100 mL的0.3 mol·L-1的
则被还原为A3+,又知100 mL的0.3 mol·L-1的![]() 与150 mL的0.6 mol·L-1B2-恰好完全反应,则
与150 mL的0.6 mol·L-1B2-恰好完全反应,则![]() 中的n值为( )
中的n值为( )
A.4B.5C.6D.7
查看答案和解析>>
科目: 来源: 题型:
【题目】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态 Cl原子核外电子排布式__________________________,P、S、Cl的第一电离能由大到小顺序
为____________________。
(2)SCl2分子中的中心原子杂化轨道类型是_____________,该分子构型为__________。
(3)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为__________。
(4)已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66 pm和69 pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_____________。
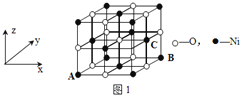
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为______。
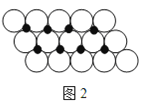
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+ 填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为______g。(用a、NA表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】欲使0.1 mol/L NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减小,其方法是( )
A. 通入二氧化碳气体 B. 加入氢氧化钠固体
C. 通入氯化氢气体 D. 加入饱和石灰水溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 10 gD2O中含有的质子数与中子数均为5NA
B. 标准状况下,22.4LCHC13中含C-Cl键的数目为3NA
C. 密闭容器中,1mol NH3和1molHCl反应后气体分子总数为NA
D. l00mL1.0 mol/L FeC13溶液与足量Cu反应,电子转移数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾KAl(SO4)2.12H2O]在造纸等方面应用广泛。实验室中采用废易拉罐(含有Al和少量Fe、Mg杂质)制备明矾的流程如图所示:
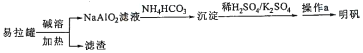
下列叙述错误的是
A. 回收处理废易拉罐有利于保护环境和资源再利用
B. “沉淀”为Al2(CO3)3
C. “操作a”中包含蒸发浓缩、冷却结晶
D. 上述流程中可用过量CO2代替NH4HCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目: 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)CO2的重整用CO2和H2为原料可得到CH4燃料。
已知:①CH4(g)+CO2(g)=2CO(g)+2H2(g)△H1=+247kJ/mol
②CH4(g)+H2O(g)=CO(g)+3H2(g)△H2=+205kJ/mol
则CO2重整的热化学方程式为______。
(2)“亚硫酸盐法”吸收烟中的SO2,将烟气通入1.0mol/L的Na2SO3溶液,若此过程中溶液体积不变,则溶液的pH不断______(填“减小”、“不变”或“增大)。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂,此时溶液中c(SO32-)=0.2mol/L,则溶液中c(HSO3-)=______;
(3)催化还原法去除NO.一定条件下,用NH3消除NO污染,其反应原理:4NH3+6NO![]() 5N2+6H2O.不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图1所示。
5N2+6H2O.不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图1所示。
①随温度升高NO脱除率下降的原因是______;
②曲线a中,NO的起始浓度为6×10-4mgm-3,从A点到B点经过0.8s,该时间段内NO的脱除速率为______mgm-3s-1;
③曲线b对应NH3与NO的物质的量之比是______。
(4)间接电化学法除NO.其原理如图2所示:写出阴极的电极反应式(阴极室溶液呈酸性)______;
吸收池中除去NO的离子方程式为______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com