
科目: 来源: 题型:
【题目】室温下如图,关闭活塞,在左右两室(体积相同)各充入一定量H2和Cl2,且恰好使两容器内气体密度相同,打开活塞,点燃使H2与Cl2充分反应生成氯化氢气体:H2+Cl2=2HCl,恢复到原温度后,下列判断正确的是

A. 开始时左右两室分子数相同
B. 最终容器内无H2存在
C. 反应前后H2室压强相同
D. 最终容器内密度与原来相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.1mol H2O的质量为18g/mol
B.40gNaOH溶解在1L水中,形成溶液溶质的物质的量浓度为1mol/L
C.3.01×1023个SO2分子质量为32 g
D.标准状况下,1mol任何物质体积均为22.4L/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,22.4LH2O含有的分子数为1NA
B.常温常压下,1.06gNa2CO3含有的Na+离子数为0.01NA
C.通常状况下,1NA个CO2分子占有的体积为22.4L
D.氧气和臭氧组成的4.8g混合气体中含有0.3NA个氧原子
查看答案和解析>>
科目: 来源: 题型:
【题目】下面关于原电池的说法,正确的是
A.在正极上发生氧化反应 B.化学性质较活泼的一极为负极
C.在外电路中电子流出的极为正极 D.原电池是将电能转化为化学能的装置
查看答案和解析>>
科目: 来源: 题型:
【题目】新华社报道:全国农村应当在“绿色生态·美丽多彩·低碳节能·循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃、101 kPa时:
①C(s)+O2(g)===CO(g) ΔH=-126.4 kJ/mol
②2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol
③H2O(g)===H2O(l) ΔH=-44 kJ/mol
则在25℃、101kPa时:
C(s)+H2O(g)===CO(g)+H2(g) ΔH=________。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g) ![]() Fe(s)+CO2(g) ΔH>0
Fe(s)+CO2(g) ΔH>0
已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值________(填“增大”“减小”或“不变”)。
②1 100℃时测得高炉中,c(CO2)=0.025 mol/L,c(CO)=0.1 mol/L,则在这种情况下,该反应是否处于化学平衡状态?________(填“是”或“否”),其判断依据是______________________。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。
现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如下图所示。
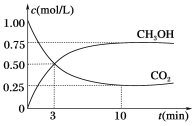
①从反应开始到平衡,氢气的平均反应速率v(H2)=________。
②下列措施能使![]() 增大的是______(填字母)。
增大的是______(填字母)。
A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g),使体系压强增大
查看答案和解析>>
科目: 来源: 题型:
【题目】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:

回答下列问题:
(l)反应![]() 的△H= _________ kJ/mol 。
的△H= _________ kJ/mol 。
(2)解聚反应在刚性容器中进行。
①其他条件不变,有利于提高双环戊二烯平衡转化率的条件是 ____ (填标号).
A.升高温度 B.降低温度 C.增大压强 D.减小压强
②实际生产中常通入水蒸气以降低双环戊二烯的沸点。某温度下,通入总压为l00kPa的双环戊二烯和水蒸气,达到平衡后总压为160kPa,双环戊二烯的转化率为8 0%,则 pH2O=___kpa,平衡常数Kp=______kPa (Kp为以分压表示的平衡常数)
(3) 一定条件下,将环戊二烯溶于有机溶剂中进行氢化反应,反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如下图所示。

①将环戊二烯溶于有机溶剂中可减少二聚反应的发生,原因是____,
②最佳的反应时间为__h。活化能较大的是__(填“氢化反应”或“副反应”)。
(4)已知氢化反应平衡常数为1.6 × 1012,副反应的平衡常数为2.0×10l2。在恒温恒容下,环戊二烯与氢气按物质的量之比为1:1进行反应,则环戊二烯的含量随时间变化趋势是____(不考虑环戊二烯的二聚反应)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛矿工业中的硫酸酸性废水富含Ti、Fe等元素,其综合利用如下:

已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为________________。
(2)步骤Ⅰ中加入铁屑的作用是________________________。(以离子方程式表示)
(3)操作a是_________ 、__________、过滤、洗涤、干燥 。
(4)步骤Ⅲ中发生反应的化学方程式为________________________;反应温度一般需控制在35℃以下,其目的是____________________________________。
(5)已知Ksp=[Fe(OH)2] = 8×10-16。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,所得的FeCO3中没有Fe(OH)2。则溶液中c(Fe2+)小于________ mol/L。步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是___________。
(6)向“富含TiO2+溶液”中加入Na2CO3粉末易得到固体TiO2 nH2O。请结合平衡移动原理和化学用语解释其原因_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】摩尔质量为Mg·mol-1的气态化合物VL (已换算成标准状况) 溶于mg 水中,得到溶液的溶质质量分数为ω%,物质的量浓度为cmol·L-1,密度为ρg·cm-3,则下列说法正确的是( )
A. M 可表示为![]() B. c 可表示为
B. c 可表示为![]()
C. ω%可表示为![]() D. ρ可表示为
D. ρ可表示为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH- ΔH>0,下列叙述正确的是
H++OH- ΔH>0,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量CH3COOH,平衡逆向移动,c(H+)降低
C. 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
D. 将水加热,KW增大,c(H+)不变
查看答案和解析>>
科目: 来源: 题型:
【题目】某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是
①该氯原子的相对原子质量为12 a/b
②m g该氯原子的物质的量为m/(aNA) mol
③该氯原子的摩尔质量是aNA g
④a g该氯原子所含的电子为17 mol
A. ①② B. ②④ C. ①③ D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com