
科目: 来源: 题型:
【题目】下列提供了有关物质的熔点,根据表中的数据,下列判断错误的是

A. AlF3晶体是离子晶体,AlCl3晶体是分子晶体
B. AlF3晶体的晶格能小于NaCl晶体的晶格能
C. 同族元素的氧化物可以形成不同类型的晶体
D. 不同族元素的氯化物可以形成相同类型的晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于晶体说法的正确组合是
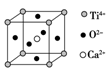
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④
C.③⑤⑦ D.③⑤⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组利用下图装置探究验证黄铜矿(主要成分CuFeS2)在空气中的氧化产物并测定CuFeS2的纯度(杂质为SiO2)。
实验步骤:①组装好仪器,检查装置的气密性良好。②加入药品,打开弹簧夹,从左口不断鼓入空气。③点燃B处的酒精喷灯,高温灼烧石英管中黄铜矿的样品。

请回答下列问题。
(1)仪器A中的试剂是________,其作用为________。
(2)为检验灼烧氧化黄铜矿产生的气体,则C、D中的试剂可选择________(多选)。
a.Na2S溶液、NaOH溶液
b.BaCl2溶液、NaOH溶液
c.品红溶液、NaOH溶液
d.KMnO4溶液、NaOH溶液
(3)查阅资料:
①样品经煅烧后得到的固体可能为泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO)。
②Cu2O与稀H2SO4的反应为:Cu2O+H2SO4=Cu+CuSO4+H2O
探究Ⅰ:为验证熔渣的成分,取分离出的熔渣少许于试管中,加入适量的稀硫酸溶解,取两份所得液。完成下表中横线上的内容。
试样 | 加入试剂及操作 | 实验现象 | 得出结论 |
第一份 | 滴入几滴K3Fe(CN)6]溶液 | ________ | 含FeO |
第二份 | 滴入几滴________溶液 | 溶液变为血红色 | 含Fe2O3 |
探究Ⅱ:设计实验方案验证泡铜中是否含有Cu2O?________。
(4)为测定CuFeS2的纯度,称取a g的黄铜矿样品充分燃烧后,甲、乙两组同学设计如下两个不同的实验方案(以下纯度结果均用含相应字母的代数式表示)。
甲方案:若C试管中为足量的H2O2和NaOH的混合溶液,吸收完气体后向C中加入过量的BaCl2溶液振荡且静置,经过滤后处理得到固体为w g,则CuFeS2的纯度为________。写出C试管中吸收气体时的总反应的离子方程式________。
乙方案:从上述煅烧产物中分离出泡铜,使其完全溶于稀硝酸并配成250mL的溶液,取出25.00mL该溶液用c mol·L-1的标准液EDTA(用H2Y2-表示)滴定至终点(滴定荆不与杂质反应),消耗EDTA标准液V mL,则CuFeS2的纯度为________。(滴定时的反应为:Cu2++H2Y2-=CuY2-+2H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】(化学——选修5:有机化学基础)
我国科学家在合成、生产生物医用材料——新型增塑剂(DEHCH)方面获得重要进展,该增塑剂可由有机物D和L制备,其结构简式如下:

(1)有机物D的一种合成路线如下:

已知: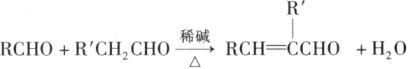
(R、R表示烃基或氢)
①由C2H4生成A的化学方程式是________。
②试剂a是________
③写出B中所含官能团的名称________。
④有机物D的结构简式是________。
(2)增塑剂(DEHCH)的合成路线如下:
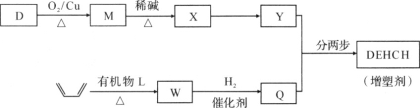
已知:
⑤D→M的化学方程式是________。
⑥有机物L的分子式为C4H2O3,核磁共振氢谱显示只有一种化学环境的氢原子。W的结构简式是________。
⑦以Y和Q为原料合成DEHCH分为两步反应,写出有关化合物的结构简式:

中间产物的结构简式是________,反应a的反应类型是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】
硼元素对植物生长及人体健康有着十分重要的作用,硼的化合物被广泛应用于新材料制备、生活生产等诸多领域。
(1)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)
A.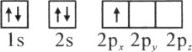
B.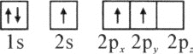
C.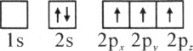
D.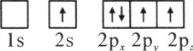
(2)晶体硼单质能自发呈现出正二十面体的多面体外形,这种性质称为晶体的________。
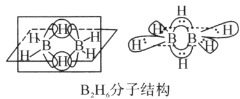
(3)硼元素的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图,则B原子的杂化方式为________。
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是________,写出一种与氨硼烷互为等电子体的分子________(填化学式)。
(4)以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂。
①H3BO3晶体中单元结构如图Ⅰ所示。各单元中的氧原子通过________氢键(用“A—B…C”表示,A、B、C表示原子)连结成层状结构,其片层结构如图Ⅱ所示,层与层之间以________(填作用力名称)相结合构成整个硼酸晶体。
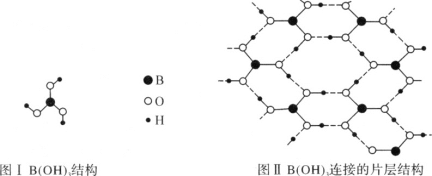
②硼氢化钠中![]() 的键角大小是________,立体构型为________。
的键角大小是________,立体构型为________。
③根据上述结构判断下列说法正确的是________
a.H3BO3分子的稳定性与氢键有关
b.硼酸晶体有滑腻感,可作润滑剂
c.H3BO3分子中硼原子最外层为8e-稳定结构
d.含1mol H3BO3的晶体中有3 mol氢键
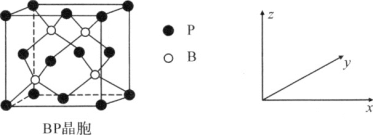
(5)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是________;已知晶胞边长为a pm,则磷化硼晶体的密度是________g·cm-3(列出含a、NA的计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,还可利用CO2据电化学原理制备塑料,既减少工业生产对乙烯的依赖,又达到减少CO2排放的目的。
(1)利用CO2和H2反应合成甲醇的原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示:
ω(CuO)/% | 10 | 20 | 30 | 4b | 50 | 60 | 70 | 80 | 90 |
CH3OH的产率 | 25% | 30% | 35% | 45% | 50% | 65% | 55% | 53% | 50% |
CO2的转化率 | 10% | 13% | 15% | 20% | 35% | 45% | 40% | 35% | 30% |
由表可知,CuO的质量分数为________催化效果最佳。
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)
CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)
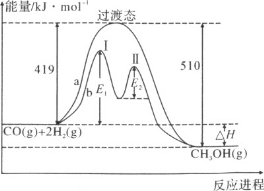
A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)①在1L的恒定密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示,则压强P2________P1(填“>”、“<”或“=”);平衡由A点移至C点、D点移至B点,分别可采取的具体措施为________、________;在c点时,CO的转化率为________。
②甲和乙两个恒容密闭容器的体积相同,向甲中加入1molCO和2molH2,向乙中加入2molCO和4molH2,测得不同温度下CO的平衡转化率如图2所示,则L、M两点容器内压强:P(M)________2P(L);平衡常数:K(M)________K(L)。(填“>”、“<”或“=”)

(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是________。
②工业上生产1.4×102kg的LDPE,理论上需要标准状况下________L的CO2。
查看答案和解析>>
科目: 来源: 题型:
【题目】在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )

A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.根据下列各题中所给出的数据,可分别求出其“溶液的溶质质量分数”或“溶液的物质的量浓度”,试判断并求解。
(1)已知某NaOH溶液V L中含有n个OH-,可求出此溶液的_______为________。
(2)已知某NaOH溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液的_______为_________。
Ⅱ.常温下,10.0 mL 1.0 mol/L的H2SO4溶液,加水稀释到500 mL,所得H2SO4溶液的浓度为________mol/L;蒸发浓缩,使溶液的体积为2.5 mL,所得H2SO4溶液的浓度为______mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】欲配制500mL 0.2mol/L的Na2CO3溶液,回答下列问题:
(1)通过计算可知,应用托盘天平称取___________g Na2CO3。
(2)除用到天平外,还一定会用到的玻璃仪器有烧杯、玻璃棒、_____________、_______________
(3)下列操作使所配溶液浓度偏大的是_____________(填写序号)。
A.称取28.6g Na2CO3·10H2O进行配制
B.称量时用了生锈的砝码
C.往容量瓶转移溶液时,有少量液体溅出
D.Na2CO3中含有不溶性杂质
E.未洗涤溶解Na2CO3的烧杯
F.定容时俯视刻度线
G.容量瓶未干燥即用来配制溶液
H.砝码与药品位置放反了且用了游码
查看答案和解析>>
科目: 来源: 题型:
【题目】某过碳酸钠中含有少量过氧化钠,甲、乙两位同学各称取一定质量的该样品,并用如下图所示仪器测定样品的纯度。仪器的连接顺序,甲同学:⑤—⑧—③—⑦—④;乙同学:⑤—③—②。装置气密性良好。
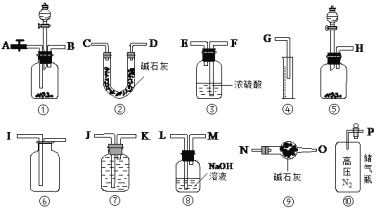
已知:过碳酸钠(Na2CO4)、过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O。
(1)甲同学选用的装置_________(填序号)是没有必要的。实验中甲同学称取固体样品质量为a g,测得气体体积为V L,实验条件下的气体摩尔体积为Vm(L/mol),则Na2CO4的质量分数为______(用含a、V、Vm的代数式表示)。
(2)乙同学想通过实验测得的数据是_______。按他测得的数据计算出的实验结果有可能偏低,原因是________________。
(3)为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用。按从左到右排列)_____________(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com