
科目: 来源: 题型:
【题目】二醚水蒸气重整制氢过程涉及的主要反应如下:
i CH3OCH3(g)+H2O(g)===2CH3OH(g) △H=+23. 6 kJ·mol-1
ii CH3OH (g)+ H2O (g)=CO2(g)+3H2(g) △H=+49. 5 kJ·mol-1
iii CH3OH (g)==CO(g)+2H2(g) △H=+90.7 kJ·mol-1
iv H2O (g)+ CO (g)= CO 2(g)+ H2(g) △H=-41.2 kJ·mol-1
各反应平衡常数与温度变化关系如下表:
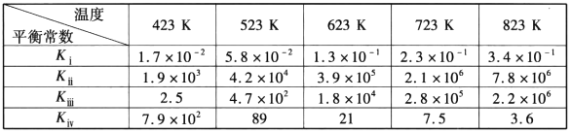
(1)重整反应CH3OCH3(g)+3H2O(g)===2CO2(g)+6H2(g) △H=x kJ·mol-1,回答下列问题:
①x=___________
②有利于提高重整反应中CH3OCH3平衡转化率的条件为___________(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
③若在恒温刚性容器中进行重整反应,达到平衡时[CH3OCH3]=10mol·L-1,[H2O]=0.2mol·L-1,[H2]=10 mol·L-1,[CO2]=40 mol·L-1则反应温度约为___________。
④723K时,v=k·[c(CH3OCH3)]2·[c(CO2)]-1.5为重整反应速率方程。在相同条件下,c(CO2)分别为a、b、c时,H2产率随时间的变化关系如图,则a、b、c由小到大的顺序为___________。
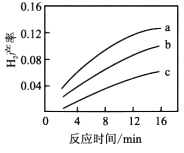
(2)CO会造成燃料电池催化剂中毒,重整反应体系中CO体积分数随水醚比与温度的变化关系如右图。

①相同温度下,水醚比为___________时CO体积分数最高。
②实际生产中选择反应温度为250℃的原因为___________;选择水醚比为3~6的原因为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.10 mol/LNaOH溶液分别滴定20.00mL浓度均为0.10mol/LCH3COOH溶液和HCN溶液,所得滴定曲线如右图所示。下列说法错误的是

A. 点①和点②所示溶液中:c(CH3COO-)>c(CN-)
B. 点③和点④所示溶液中水的电离程度:③>④
C. 点①和点②所示溶液中:c(CH3 COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D. 相同条件,浓度均为0.10mol/L CH3COOH溶液和HCN溶液的导电性:CH3COOH>HCN
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
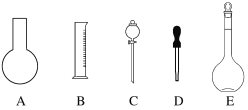
(1)①如图所示的仪器中配制溶液肯定不需要的是____________________(填字母),
②配制上述溶液还需用到的玻璃仪器是__________________(填仪器名称)。
③下列有关容量瓶使用说法不正确的是( )
a.容量瓶使用前一定要检查是否漏液。其操作为装水盖上瓶塞→倒立观察是否漏夜→正立→玻璃塞旋转180°→再倒立观察是否漏夜。
b.不能作为反应容器或长期贮存溶液的容器;但是可以配制任意体积的溶液。
c.不能将固体或浓溶液直接在容量瓶中溶解或稀释;不能加入过冷或过热的液体 。
d.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度___________(填“>”、“<”或“=”)0.1 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗涤烧杯和玻璃棒→洗涤液移入容量瓶→定容,则所得溶液浓度___________(填“>”、“<”或“=”) 0.1 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为__________(计算结果保留一位小数)mL;
②如果实验室有15 mL、50 mL、100 mL量筒,应选用___________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在周期表中的位置如下图所示,Y2+与W-的电子数之差为8。下列说法正确的是

A. 原子半径大小:X>Y
B. 最高价氧化物对应水化物的酸性:Z>W
C. 工业上通过电解Y的氧化物制取Y单质
D. X与W可形成正四面体结构的有机物
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在一固定体积的密闭容器中,对于可逆反应A(s)+3B(g)![]() 2C(g),下列说法不能说明达到化学平衡状态的是
2C(g),下列说法不能说明达到化学平衡状态的是
A. 气体密度不再变化 B. 混合气体的总压强不再变化;
C. A、B、C的物质的量之比为1∶3∶2 D. 混合气体的平均相对分子质量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示原电池的盐桥中装有饱和K2SO4溶液,电池工作一段时间后,甲烧杯中溶液颜色不断变浅。下列叙述中正确的是
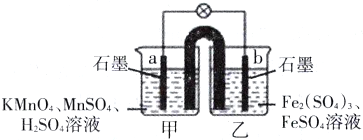
A. b极是电池的正极
B. 甲烧杯中K+经盐桥流向乙烧杯
C. 甲烧杯中溶液的pH逐渐减小
D. 电池的总反应离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 对于A(s)+B(g) ![]() C(g)+D(g)的反应,加入A,反应速率加快
C(g)+D(g)的反应,加入A,反应速率加快
B. 2NO2![]() N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
C. 一定温度下,反应 N2(g)+3H2(g) ![]() 2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
D. 100 mL2 mol·L—1稀盐酸与锌反应时,加入少量硫酸铜固体,生成氢气的速率加快
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实能用勒夏特列原理来解释的是
A. 实验室采用排饱和食盐水的方法收集氯气Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B. 工业上合成氨反应N2(g)+ 3H2 (g)![]() 2NH3(g) △H<0 选择500 ℃
2NH3(g) △H<0 选择500 ℃
C. H2、I2、HI平衡混合气体加压后颜色加深H2(g)+ I2(g)![]() 2HI(g)
2HI(g)
D. SO2氧化成SO3,往往需要使用催化剂2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
查看答案和解析>>
科目: 来源: 题型:
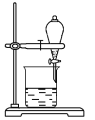
【题目】Ⅰ(1)用CCl4萃取碘水中的碘,下图的分液漏斗中,下层液体呈______色;打开分液漏斗活塞,却未见液体流下,原因可能是_____。
Ⅱ 某同学用某种粗盐进行提纯实验,步骤见下图。
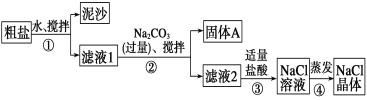
请回答下列问题:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法是______________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了____________,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | _______ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | _____ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,________ | _______ | 猜想Ⅲ成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com