
科目: 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E;其中,A、C同周期,B、C同主族;A与B 形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
(1)画出元素C的原子结构示意图:________。
(2)写出元素D在元素周期表中的位置:第____周期,第____族;该元素形成的单质的结构式为______。
(3)写出下列物质的电子式:A、B、E形成的化合物______;D、E形成的化合物______。
(4)D、E形成的化合物受热蒸发,吸收的热量用于克服________。
(5)A、B两元素组成的化合物A2B2属于______(填“离子”或“共价”)化合物,其存在的化学键有______。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据能量变化示意图,下列说法正确的是( )

A. 状态1是液态,则状态3一定是气态
B. 状态3是液态,则状态4一定是气态
C. A(状态2)+B(g)═C(状态3)+D(g)△H=(d﹣a)kJmol﹣1
D. 断裂1molC(状态3)和1molD(g)中的化学键需要吸收的能量为(e﹣d)kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】现有三个反应:
反应① Fe(s)+H2O(g)![]() FeO(s)+H2(g) △H1 平衡常数为K1
FeO(s)+H2(g) △H1 平衡常数为K1
反应② CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2 平衡常数为K2
H2(g)+CO2(g) △H2 平衡常数为K2
反应③ Fe(s)+CO2 (g)![]() FeO(s)+CO(g) △H3 平衡常数为K3
FeO(s)+CO(g) △H3 平衡常数为K3
在不同温度下,部分K1、K2的值如下:
T/℃ | 700 | 800 |
K1 | 2.38 | 2.56 |
K2 | 0.80 |
(1)K1的表达式为________;根据反应①、②、③推导出K1、K2、K3的关系式K3=______。
(2)要使反应①在一定条件下建立的平衡右移,可采取的措施有_________。(填字母)
A.缩小容器体积 B.降低温度 C.升高温度
D.使用合适的催化剂 E.设法减少H2的量 F.设法减少FeO的量
(3)800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应②,反应过程中测定的部分数据见下表:
反应时间/min | 0 | 2 | 4 | 6 |
n(CO)/mol | 1.20 | 0.90 | 0.80 | |
n(H2O)/ mol | 0.60 | 0.20 |
①反应在2 min内的平均速率为v(H2O)=________________;
②800℃时,K2的值为_______________;
③保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率_______________(填“增大”或“减小”或“不变”)。
(4)由以上信息推断反应③正反应方向为________(填“放热”或“吸热”)反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】图为一种特殊的热激活电池示意图,当无水LiCl-KCl混合物受热熔融后即可工作。 该电池总反应为: PbSO4(s)+2LiCl+Ca(s) = CaCl2(s)+Li2SO4+Pb(s)。下列说法不正确的是
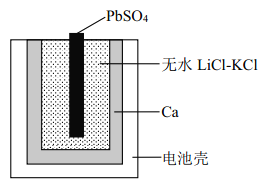
A. PbSO4 电极发生还原反应
B. 负极的电极反应:Ca + 2Cl--2e-=CaCl2
C. 放电时 Li+、 K+向正极移动
D. 用 LiCl 和 KCl 水溶液代替无水 LiCl-KCl,可将该电池改为常温使用的电池
查看答案和解析>>
科目: 来源: 题型:
【题目】在下图所示的物质转化关系中。 C、G、I、M为常见单质,G和M化合可生成最常见液体A,E为黑色粉末,F的焰色反应为黄色,K为白色沉淀,N为红褐色沉淀,I为黄绿色气体,化合物B的摩尔质量为24 g ·mol-1。(部分生成物和反应条件未列出)

(1)L的化学式为______________。
(2)A的电子式为______________。
(3)反应②的离子方程式为____________________________________。
(4)反应③的化学方程式为____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 向水中通入氯气:Cl2+H2O2H++Cl﹣+ClO﹣
B. 二氧化锰与浓盐酸反应:MnO2+4HCl(浓)![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
C. 碳酸氢钠溶液加过量澄清石灰水:2HCO3﹣+Ca2++2OH﹣═CaCO3↓+2H2O+CO32﹣
D. 金属钠与硫酸铜溶液反应:2Na+2H2O+Cu2+═2Na++Cu(OH)2↓+H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】美国夏威夷联合天文中心的科学家发现了新的氢微粒,该微粒是由3个氢原子核(只含质子)和2个电子构成,关于这种微粒的下列说法中正确的是
A. 是氢元素的一种新的同素异形体
B. 是氢元素的一种新的同位素
C. 该微粒的组成可用H3表示
D. 该微粒比普通氢分子多一个氢原子核
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。一种回收废旧磷酸亚铁锂电池正极片(主要成分LiFePO4、炭黑和铝箔)中金属的流程如下:

(1)步骤①中“碱溶”反应的化学方程式为_____。
(2)步骤②中反应的离子方程式为_____。若用H2O2代替HNO3,其优点是_____。
(3)步骤③沉淀的主要成分是_____。
(4)步骤④中生成含Li沉淀_____(填“能”或“不能”)用硫酸钠代替碳酸钠,原因是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图,其中反应Ⅲ制取ClO2的化学方程式为2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O。

(1)试剂X是________(填化学式);操作A的名称是________。
(2)分析上述流程,写出反应Ⅱ的化学方程式:________________________________。
(3)用ClO2处理过的饮用水常含有一定量有害的ClO2-。我国规定饮用水中ClO2-的含量应不超过0.2 mg·L-1。测定水样中ClO2、ClO2-的含量的过程如下:
①量取20 mL水样加入到锥形瓶中,并调节水样的pH为7.0~8.0。
②加入足量的KI晶体。此过程发生反应2ClO2+2I-=2 ClO2-+I2。
③加入少量淀粉溶液,再向上述溶液中滴加1×10-3 mol·L-1 Na2S2O3溶液至溶液蓝色刚好褪去,消耗Na2S2O3溶液5.960 mL。此过程发生反应:2S2O32-+I2=S4O62-+2I-。
④调节溶液的pH≤2.0,此过程发生反应ClO2-+4H++4I-=Cl-+2I2+2H2O。
⑤再向溶液中滴加1×10-3 mol·L-1 Na2S2O3溶液至蓝色刚好褪去,消耗Na2S2O3溶液24.00 mL。根据上述数据计算并判断该水样中ClO2-的含量是否超过国家规定____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com