
科目: 来源: 题型:
【题目】工业制玻璃主要原料有石英、纯碱和石灰石.在玻璃窑中发生主要反应的化学方程式为:①Na2CO3+SiO2![]() Na2SiO3+CO2↑;②CaCO3+SiO2
Na2SiO3+CO2↑;②CaCO3+SiO2![]() CaSiO3+CO2↑。
CaSiO3+CO2↑。
(1)反应①中,被破坏的微粒间的作用力有__________(选填编号)。
a. 范德华力 b. 离子键 c. 共价键
(2)上述两个反应的反应物和生成物中,涉及到的不同类型的晶体有____种(填数字),其中熔沸点最低的化合物的电子式为___;该化合物熔沸点低于CS2的原因是____。
(3)纯碱中的金属阳离子的半径比铝离子半径______(填“大”或“小”);石灰石中的金属阳离子的电子所占据的电子层中,能量最高的是___层(填“电子层符号”)。
(4)已知10 g碳酸钙完全分解,共吸收17.56 KJ的热量,写出该反应的热化学方程式:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下图中甲池的总反应式为N2H4+O2===N2+2H2O。甲池中负极上的电极反应式为_________,乙池中石墨电极上发生的反应为_______________。甲池中每消耗0.1 mol N2H4,乙池电极上则会析出_________ g固体。

(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。下图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的_______极(填“正”或“负”)。F电极上的电极反应式为______________。

(3)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子。S(g)在负极生成SO3的电极反应式为____________________。已知S(g)在负极发生的反应为可逆反应,为提高硫蒸气的转化率,该工艺采取的措施有____________(任写一条)。
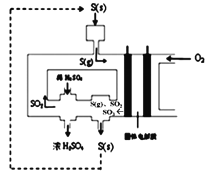
查看答案和解析>>
科目: 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgSO4固体。
A. ①②③⑤ B. ③⑥ C. ③ D. ③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物M可用于消毒剂、抗氧化剂、医药中间体。实验室由芳香烃A制备M的一种合成路线如下:

请回答:
(1)B的化学名称为___________;D中官能团的名称为______________________。
(2)由F生成G的反应类型为___________;F的分子式为___________。
(3)由E转化为F的第一步反应的化学方程式为______________________。
(4)M的结构简式为___________。
(5)芳香化合物Q为C的同分异构体,Q能发生银镜反应,其核磁共振氢谱有4组吸收峰。写出符合要求的Q的一种结构简式______________________。
(6)参照上述合成路线和信息,以苯甲酸乙酯和CH3MgBr为原料(无机试剂任选),设计制备 的合成路线_________________________________。
的合成路线_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏伽德罗常数,下列说法正确的是( )
A.6.2 g Na2O所含的离子数为0.2 NA
B.46 gNO2与N2O4的混合气体中所含的原子数是3NA
C.2.8 gN2中含有共用电子对的数目为0.1 NA
D.0.1 molH2与Cl2的混合气体充分反应后,体系中含有共价键总数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中___________区;第二周期元素中,第一电离能比氧大的有___________种。
(2)O3可用于消毒。O3的中心原子的杂化形式为___________;其分子的 VSEPR模型为___________,与其互为等电子体的离子为___________(写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为___________;C2H5OH不能用无水CaCl2千燥是因为Ca2+和C2H5OH可形成[Ca(C2H5OH)4]2+,该离子的结构式可表示为______________________。
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。

①FeO立方晶胞结构如图1所示,则Fe2+的配位数为___________;与O2-紧邻的所有Fe2+构成的几何构型为___________。
②Cu2O立方晶胞结构如图2所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为___________g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。
请回答:
(1)已知一定条件下发生如下反应:
CO2(g)+2H2O(g)![]() CH4(g)+2O2(g) △H=+802kJ·mol-1。
CH4(g)+2O2(g) △H=+802kJ·mol-1。
将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=___________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0~20h内该反应速率v(H2O)=___________。

③根据图1判断,T1___________T2(填“>”“<”或“=”),理由为___________。
催化剂的催化效果:M___________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(![]() )与温度(T)的关系如图2所示。
)与温度(T)的关系如图2所示。
①T0℃时,CO的体积分数最大的原因为_________________________________。
②若T0℃时,容器内起始压强为p0,CO的平衡体积分数为10%,则反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下四种气体:
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(1)质量由大到小的顺序为____________。
(2)气体密度由大到小的顺序为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】若用CH3COOD与CH3CH2OH在浓硫酸作用下发生酯化反应,一段时间后分子中存在D原子的是( )
①乙酸,②乙醇, ③乙酸乙酯,④水
A. ①④B. ①③④C. ①②③④D. ①②④
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,分别向NaA溶液和MCl溶液中加入盐酸和NaOH溶液,混合溶液的pH与离子浓度变化关系如下图所示。下列说法不正确的是

A. 曲线L1表示![]() 与pH的变化关系
与pH的变化关系
B. Ka(HA)=1×10-5.5
C. a点时两溶液中水的电离程度相同
D. 0.01mol·L-1MA溶液中存在:c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com