
科目: 来源: 题型:
【题目】下列事实不能用勒夏特利原理来解释的是
A. 用排饱和食盐水的方法收集氯气
B. 增大压强,有利于SO2和O2反应生成SO3
C. 在Fe3++3SCN-![]() Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
D. 合成氨工业选择高温(合成氨反应为放热反应)
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、R为五种短周期主族元素,Y、Z、W是原子序数递增的同周期相邻元素,且最外层电子数之和为15;X比Y核外少一个电子层;R的质子数是X、Y、Z、W四种元素质子数之和的![]() .下列说法正确的是( )
.下列说法正确的是( )
A. 简单离子半径:![]()
B. X与Y形成的二元化合物常温下一定为气态
C. W和R形成的化合物是离子化合物
D. Y与W、Z与W形成的二元化合物都是大气污染物
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学学习小组用如下图所示装置制备、收集Cl2,并进行性质验证实验(夹持装置略去)。下列说法正确的是( )

A. 用![]() 和浓盐酸制备
和浓盐酸制备![]() 时,只选
时,只选![]()
B. ![]() 用于
用于![]() 收集时,a为进气口
收集时,a为进气口
C. ![]() 中加入NaBr溶液和
中加入NaBr溶液和![]() ,通入
,通入![]() 反应后振荡、静置,下层溶液呈橙红色
反应后振荡、静置,下层溶液呈橙红色
D. ![]() 中通入
中通入![]() 使品红溶液褪色后,取出溶液加热可恢复红色
使品红溶液褪色后,取出溶液加热可恢复红色
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目。____________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4—+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4—+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:______,MnO![]() +Fe2++H+=Mn2++Fe3++H2O
+Fe2++H+=Mn2++Fe3++H2O
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________ mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】①在NH4NO3中氮元素显+5价;
②4FeS2+11O2![]() 2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
③2Cu+O2![]() 2CuO反应中Cu元素化合价降低总数与O元素化合价升高总数一定相等。这3种说法中错误的是
2CuO反应中Cu元素化合价降低总数与O元素化合价升高总数一定相等。这3种说法中错误的是
A.①B.②③C.①③D.①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是( )
A. 液溴易挥发,在存放液溴的试剂瓶中应加水封
B. 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C. 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D. 某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
查看答案和解析>>
科目: 来源: 题型:
【题目】现代火法炼锌过程中发生了以下三个主要反应。下列说法正确的是
① 2ZnS(s) + 3O2(g)=2ZnO(s)+2SO2(g) △H1=a kJ mol-1
② 2C(s) +O2(g)=2CO(g) △H2=b kJ mol-1
③ ZnO(s) +CO(g)=Zn(g) +CO2(g) △H3=c kJ mol-1
A. 以上三个反应中,只有①是放热反应
B. 反应②的作用是仅为反应③提供还原剂
C. 用这种方法得到的是纯净的锌单质
D. 反应ZnS(s)+C(s)+2O2(g)=Zn(g)+SO2(g)+CO2(g)的△H=![]() kJ mol-1
kJ mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】一种从铜电解工艺的阳极泥中提取Se和Te的流程如下:
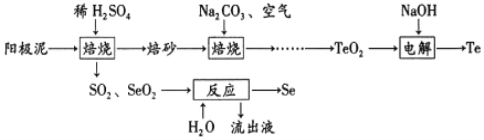
下列叙述错误的是( )
A. 合理处理阳极泥有利于保护环境和资源再利用
B. 流出液是H2SO4溶液
C. 电解过程中阴极上析出单质Te
D. “焙砂”与碳酸钠充分混合后,可在瓷坩锅中焙烧
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是某学校实验室买回的硫酸试剂标签的部分内容。判断下列说法正确的是( )

A. 该硫酸的浓度为9.2 mol·L-1
B. 配制480 mL 4.6 mol·L-1的稀硫酸需该H2SO4125mL
C. 该硫酸与等体积水混合质量分数变为49%
D. 取该硫酸100 mL,则浓度变为原来的![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废水(镍主要以NiR2络合物形式存在)制取草酸镍(NiC2O4),再高温灼烧草酸镍制取三氧化二镍。工艺流程如图所示:

已知:①NiR2(aq)![]() Ni2+(aq)+2R-(aq)(R-为有机物配体,K=1.6×10-14)
Ni2+(aq)+2R-(aq)(R-为有机物配体,K=1.6×10-14)
②Ksp[Fe(OH)3]=2.16×10-39,Ksp[Ni(OH)2]=2×10-15
③Ka1(H2C2O4)= 5.6×10-2,Ka2(H2C2O4)= 5.4×10-5
④“脱络”过程中,R-与中间产物·OH反应生成·R(有机物自由基),·OH能与H2O2发生反应。有关反应的方程式如下:
i.Fe2++H2O2=Fe3++OH-+·OH
ii.R-+·OH = OH-+·R
iii.H2O2+2·OH=O2↑+2H2O
请回答下列问题:
(1)中间产物·OH的电子式是________
(2)“沉铁”时,若溶液中c(Ni2+)=0.01mol·L-1,加入碳酸钠调溶液的pH为________(假设溶液体积不变,lg6≈0.8)使Fe3+恰好沉淀完全(离子的浓度≤1.0×10-5mol·L-1),此时________(填“有”或“无”)Ni(OH)2沉淀生成。
(3)25℃时,pH=3的草酸溶液中c(C2O42-)/c(H2C2O4)________(保留两位有效数字)。“沉镍”即得到草酸镍沉淀,其离子方程式是________
(4)“灼烧”氧化草酸镍的化学方程式为_______________________________。
(5)加入Fe2+和H2O2能够实现“脱络”的原因是________。
(6)三氧化二镍能与浓盐酸反应生成氯气,写出反应的离子方程式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com