
科目: 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是( )

A. ①②中Mg作为负极,③④中Fe作为负极
B. ②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作为负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作为正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】某反应过程能量变化如图所示,下列说法正确的是

A. 反应过程a有催化剂参与
B. 该反应为吸热反应,热效应等于△H
C. 有催化剂的条件下,反应的活化能等于E1+E2
D. 改变催化剂,可改变该反应的活化能
查看答案和解析>>
科目: 来源: 题型:
【题目】图为一种特殊的热激活电池示意图,当无水LiCl-KCl混合物受热熔融后即可工作。 该电池总反应为: PbSO4(s)+2LiCl+Ca(s) = CaCl2(s)+Li2SO4+Pb(s)。下列说法不正确的是
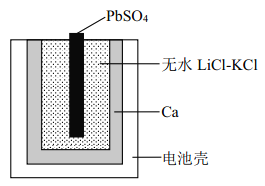
A. PbSO4 电极发生还原反应
B. 负极的电极反应:Ca + 2Cl--2e-=CaCl2
C. 放电时 Li+、 K+向正极移动
D. 用 LiCl 和 KCl 水溶液代替无水 LiCl-KCl,可将该电池改为常温使用的电池
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中,c(![]() )由大到小的顺序是________。
)由大到小的顺序是________。
A.0.2mol·L-1NH4Cl溶液 B.0.2mol·L-1NH4HCO3溶液
C.0.2mol·L-1NH4HSO4溶液 D.0.1mol·L-1(NH4)2Fe(SO4)2溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。下列说法正确是

A. 有MnO2条件下的反应曲线是a曲线
B. a曲线变为b曲线,反应的活化分子百分数增大
C. a曲线变为b曲线,平衡时H2O2的转化率增大
D. b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH= - ( E1 - E2)KJmol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释物质用途或现象的反应方程式不准确的是
A. 硫酸型酸雨的形成会涉及反应2H2SO3+O2![]() 2H2SO4
2H2SO4
B. 工业上制取粗硅的化学方程式:SiO2+C![]() Si+CO2↑
Si+CO2↑
C. Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2+S↓+H2O
D. 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+=Cl2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,下列说法正确的是

A. 气球②中装的是O2
B. 气球①和③中分子数相等
C. 气球①和④中气体物质的量之比为4︰1
D. 气球③和④中气体密度之比为2︰1
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)按要求填写下列空格(设阿伏加德罗常数为NA)
①39 g Na2O2中的Na+_________ NA;
②0.5mol H2O中的质子数为_________NA;
③1.204×1024个水分子的质量为_________ g;
④标准状况下,10g CO和CO2混合气体的体积是6.72L,则此混合气体中,CO和CO2的物质的量之比是 ;
⑤9.2g氮的氧化物NOx中含有N原子数为0.2mol,则x数值为 。
(2)用于分离或提纯物质的方法有:
A蒸馏(分馏) B萃取 C过滤 D重结晶 E分液
分离或提纯下列各组混合物,请选择上述最合适的方法的标号填在橫线上。
①除去Ca(OH)2溶液中悬浮的CaCO3微粒 ;
②分离四氯化碳与水的混合物 ;
③分离汽油和柴油 ;
④提纯氯化钠和硝酸钾混合溶液中的硝酸钾 。
(3)找出下列各组物质中与另三种物质的类别不同的一种物质,用化学式填写在后面的横线上。
① CaO、Na2O、CO2、CuO ;
② H2、N2、P、Cu ;
③ S、Fe、Cu、Zn ;
④ HCl、H2O、H2SO4、HNO3 。
查看答案和解析>>
科目: 来源: 题型:
【题目】欲配制100mL 1.0 mol/L Na2CO3溶液,正确的方法是
① 将10.6 g Na2CO3 溶于100mL水中
② 将28.6g Na2CO3·10H2O溶于水配成100 mL溶液
③ 将20 ml 5.0 mol/L Na2CO3溶液加水稀释至100 mL
A. ①②③ B. ②③ C. 只有② D. 只有③
查看答案和解析>>
科目: 来源: 题型:
【题目】以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4H2O,其主要实验流程如下:
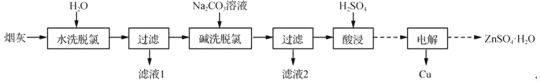
已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;
②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓(深蓝色);
③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85℃条件下进行,适宜的加热方式为_____。
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为_____。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是_____。
NaOH溶液浓度对脱氯率和其他元素浸出率的影响
NaOH浓度/molL﹣1 | 脱氯率/% | 元素浸出率/% | ||
Cl | Zn | Cu | As | |
1.0 | 51.20 | 0.51 | 0.04 | 0.00 |
2.0 | 80.25 | 0.89 | 0.06 | 58.87 |
3.0 | 86.58 | 7.39 | 0.26 | 78.22 |
(3)ZnSO4的溶解度曲线如下图所示。“电解”后,从溶液中回收ZnSO4H2O的实验、操作为_____。
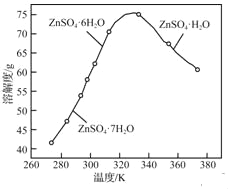
(4)滤液1和滤液2中含一定量的Cu2+、Zn2+.为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的_____(填化学式)。
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10﹣21.测得酸浸液中杂质铁元素(以Fe2+存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com