
科目: 来源: 题型:
【题目】铁及其化合物在生产、生活中有广泛的应用。
(1)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下:
①MnFe2O4(s)===MnFe2O(4-x)(s)+x/2O2(g) ΔH1
②MnFe2O(4-x)(s)+xH2O(g)===MnFe2O4(s)+xH2(g) ΔH2
③2H2O(g)===2H2(g)+O2(g) ΔH3
则:ΔH3与ΔH1、ΔH2的关系为ΔH3=________。
(2)纳米铁是重要的储氢材料,可用下列反应制得:Fe(s)+5COFe(CO)5(g) ΔH<0。在1 L恒容密闭容器中加入足量铁粉和0.5 mol CO,在T1、T2不同温度下进行反应,测得c(CO)与温度、时间的关系如图1所示。

①T1________(填“>”或“<”)T2。
②T2温度下,上述反应的平衡常数K=________(结果不要求带单位)。
(3)高铁酸钾(K2FeO4)被人们称为“绿色化学”净水剂。高铁酸钾在酸性至弱碱性条件下不稳定。
①工业上用KClO与Fe(NO3)3溶液反应制得K2FeO4,反应的离子方程式为____________________。制备K2FeO4时,KClO饱和溶液与Fe(NO3)3饱和溶液混合的操作为________________________。
②已知K2FeO4在水解过程中铁元素形成的微粒分布分数与pH的关系如图所示。


向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为____________________________________。
(4)电解法可制得K2FeO4,装置如图所示。阳极的电极反应式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】四氯化锡(SnCl4)常用于染色的媒染剂等,工业上常用氯气与金属锡反应制备四氯化锡,某研究性学习小组在实验室用以下装置模拟四氯化锡的制备(夹持装置略)。

已知:①金属锡熔点为231℃,化学活泼性与铁相似。
②SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解生成SnO2·xH2O,在潮湿的空气中发烟。
③SnCl2中的Sn2+易被氧化为Sn4+。
请回答下列问题:
(1)仪器F的名称是_______________,装置B中的试剂是_____________(填名称)。
(2)实验前应先点燃_________(填“A”或“E”)处的酒精灯,待__________(填实验现象)后,再点燃另外一处的酒精灯。
(3)若没有装置C(其他均相同),则D中发生的主要副反应的化学方程式为__________。
(4)该实验装置存在设计缺陷,你的改进措施为______________________________。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取0.7500g锡粉溶于足量稀盐酸中,向生成的SnCl2溶液中加入过量的FeCl3溶液,用物质的量浓度为0.1000molL-1 K2Cr2O7标准溶液滴定生成的Fe2+(已知酸性环境下Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液的体积为20.00mL。
①锡粒中锡的质量分数_____。
②若溶解锡粉的过程生成的SnCl2溶液中含有Sn![]() ,则测定结果将__________(填“偏高”、“偏低”或“无影响”)
,则测定结果将__________(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是一种具有抗疟药理活性的喹啉类衍生物,其合成路线流程图如下:

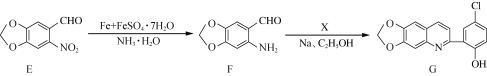
已知:
(1) F中的含氧官能团名称为________、________。
(2) B→C的反应类型为________。
(3)芳香族化合物X的分子式为C8H7ClO2,写出X的结构简式:___________________________。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:__________________________。
①分子中含有苯环,能与FeCl3溶液发生显色反应,不能发生银镜反应;
②碱性条件水解生成两种产物,酸化后分子中均只有2种不同化学环境的氢。
(5)写出以 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_________________________。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】烟气(主要污染物SO2、NOX)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中的SO2、NOx 的含量。
(1) O3氧化烟气中SO2、NOx 的主要反应的热化学方程式为: NO(g)+O3(g)![]() NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)
NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)![]() 3NO2(g) ΔH=-317.3kJ·mol-1。则2NO2(g)
3NO2(g) ΔH=-317.3kJ·mol-1。则2NO2(g)![]() 2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
(2)T℃时,利用测压法在刚性反应器中,投入一定量的NO2发生反应3NO2(g)![]() 3NO(g)+O3(g),体系的总压强 p随时间 t的变化如下表所示:
3NO(g)+O3(g),体系的总压强 p随时间 t的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
①若降低反应温度,则平衡后体系压强 p______24.00 MPa(填“>”、“<”或“=”),原因是____________。
②15min 时,反应物的转化率 α=______。
③T℃时反应3NO2(g)![]() 3NO(g)+O3(g)的平衡常数Kp=____________(Kp 为以分压表示的平衡常数,分压等于总压乘以该气体的物质的量分数)
3NO(g)+O3(g)的平衡常数Kp=____________(Kp 为以分压表示的平衡常数,分压等于总压乘以该气体的物质的量分数)
(3)T℃时,在体积为2L的密闭刚性容器中,投入2 mol NO2发生反应2NO2(g)![]() 2NO(g)+O2(g),实验测得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为T℃时NO2的转化率随时间变化的结果如图所示(反应在5.5min时达到平衡):
2NO(g)+O2(g),实验测得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为T℃时NO2的转化率随时间变化的结果如图所示(反应在5.5min时达到平衡):

①在体积不变的刚性容器中,投入固定量的NO2发生反应,要提高NO2转化率,可采取的措施是______________、___________。
②由图中数据,求出该反应的平衡常数为_________。
③计算A 点处v正/v逆=_________________________(保留1位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2 等杂质]为原料,制备金属钛和铁红的工艺流程如下:已知:①酸溶时,FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]= 1.0×10-11;请回答下列问题:
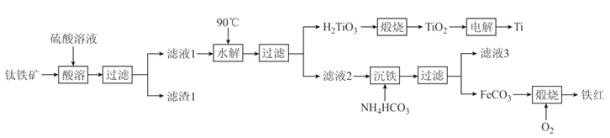
(1)FeTiO3中Ti元素的化合价为_______价。铁红的用途为________________(任写一种)。
(2)“水解”中,发生反应的离子方程式为____________________________________________。
(3)“沉铁”中,气态产物的电子式为_________;该过程需控制反应温度低于35℃,原因为_____________。
(4)FeCO3转化为铁红时,发生反应的化学方程式为________________________________________。
(5)滤液3可用于制备Mg(OH)2。若滤液3 中c(Mg2+)=1.2×10-4 mol·L-1,向其中加入等浓度等体积的NaOH溶液时,通过计算说明有无沉淀生成______________________________(溶液体积近似叠加)。
(6)电解生产钛时用TiO2和石墨做电极,电解质为熔融的CaO,则阴极反应式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸和一水合氨是中学化学中常见的弱电解质。
(1)常温下,某研究性学习小组设计了如下方案证明醋酸为弱电解质,你认为方案可行的是_______(填序号)
①配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则证明醋酸为弱电解质。
②用醋酸溶液和盐酸做导电性实验,若醋酸溶液导电性弱,则证明醋酸为弱电解质。
③将pH=2的CH3COOH溶液加水稀释100倍后,若pH>4,则证明醋酸为弱电解质。
④配制一定量的CH3COONa溶液,测其pH,若pH大于7,则证明醋酸为弱电解质。
(2)若25℃时,0.10 mol/L的CH3COOH的电离度为1%,则该溶液的pH=________,由醋酸电离出的c(H+)约为水电离出的c(H+)的_________倍。
(3)已知在25℃时,醋酸的电离平衡常数为Ka=1.8×10-5。常温下,0.1mol/LNaOH溶液V1 mL和0.2mol/LCH3COOH溶液V2 mL混合后(忽略混合前后溶液体积的变化)溶液的pH=7。
①反应后溶液中离子浓度的大小关系为_________________________________________________。
②V1:V2 __________(填“>”、“<”或“=”)2:1
③c(CH3COO-):c(CH3COOH)=__________________。
(4)常温下,可用氨水吸收废气中的CO2得到NH4HCO3溶液,在该溶液中,c(NH4+)_______(填“>”、“<”或“=”)c(HCO3-);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. H2A的电离方程式为H2A![]() H++HA -
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】甲胺(CH3NH2)是合成太阳能敏化剂的原料。一定温度下,在三个体积均为2.0 L的恒容密闭容器中按不同方式投入反应物,发生反应CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g),测得有关实验数据如下:
容器编号 | 温度/K | 起始物质的量(mol) | 平衡物质的量mol | ||||
CH3OH | NH3 | CH3NH2 | H2O | CH3NH2 | H2O | ||
I | 530 | 0.40 | 0.40 | 0 | 0 | 0.30 | |
II | 530 | 0.80 | 0.80 | 0 | 0 | ||
III | 500 | 0 | 0 | 0.20 | 0.20 | 0.16 | |
下列说法正确的是( )
A. 正反应的平衡常数K(Ⅰ)=K(Ⅱ)<K(Ⅲ)
B. 达到平衡时,体系中c(CH3OH)关系:2c(CH3OH,Ⅰ)>c(CH3OH,Ⅱ)
D. 530K时,若起始向容器Ⅰ中充入CH3OH 0.10 mol、NH3 0.15 mol、CH3NH2 0.10 mol、H2O 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图甲所示。向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图乙所示。
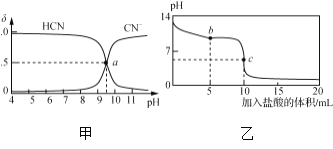
下列溶液中微粒的物质的量浓度关系一定正确的是( )
A. 图甲中pH=7的溶液:c(Cl-)=c(HCN)
B. 图甲中a点的溶液:c(CN-)<c(Cl-)
C. 图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D. 图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-)
查看答案和解析>>
科目: 来源: 题型:
【题目】某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-![]() H++A2-(Ka=1.0×10-2),下列说法正确的是( )
H++A2-(Ka=1.0×10-2),下列说法正确的是( )
A. 在0.1mol/L的Na2A溶液中,c(A2-)+c(HA-)+c(H2A)=0.1mol/L
B. 在0.1mol/L的H2A溶液中,c(H+)= 0.2 mol/L
C. 分别将浓度均为0.1mol/L的NaHA和Na2A溶液等体积混合,其pH一定大于7
D. 0.1mol/L的NaHA溶液中离子浓度为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com