
科目: 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:x A(g) + y B(g) ![]() z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
A.x + y < z B.B的转化率降低
C.平衡向正反应方向移动 D.C的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将20mL 0.10 mol/LCH3COOH溶液和20mL 0.10 mol/LHX溶液分别与20mL 0.10 mol/LNaHCO3溶液混合,测得产生气体的体积(V)随时间(t)变化如下图,下列说法中不正确的是
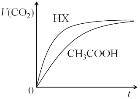
A. 反应开始前,HX溶液中c(H+)大于CH3COOH中c(H+)
B. CH3COOH溶液反应结束后,c(Na+)>c(CH3COO—)
C. 反应结束后所得两溶液中,c(CH3COO—)<c(X—)
D. 由该实验可知HX为强酸
查看答案和解析>>
科目: 来源: 题型:
【题目】利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如下图所示,下列说法正确的是
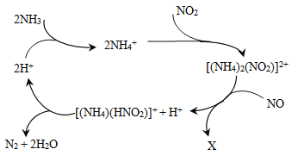
A. X是N2
B. 上述历程的总反应为:2NH3+NO +NO2![]() 2N2+3H2O
2N2+3H2O
C. NH4+中含有非极性共价键
D. NH3、NH4+、H2O中的质子数、电子数均相同
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,质量为95 g的氯化镁溶解在0.2 L水中(水的密度近似为1 g/mL)恰好得到氯化镁的饱和溶液,所得溶液的密度为ρ g/mL,物质的量浓度为c mol/L,溶解度为s,NA表示阿伏加德罗常数的值,则下列叙述中正确的是( )
A. 所得溶液中含有NA个氯化镁分子
B. 所得溶液的物质的量浓度为5 mol/L
C. 所得溶液的溶解度可表示为9500 c/(1000ρ-95c)
D. 所得溶液的质量分数可表示为95 ρ/(1000c)
查看答案和解析>>
科目: 来源: 题型:
【题目】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理排放情况。
I.实验室通过如图所示装置制备Na2S2O3
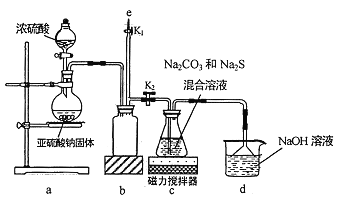
(1)实验中要控制SO2生成速率,可采取的措施有_____________(写出一条)。
(2)b装置的作用是_____________ 。
(3)反应开始后,c 中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为__________(填化学式)。
(4)实验结束后,在e处最好连接盛__________(填“NaOH 溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为______________,最后拆除装置。
II.氰化钠废水处理
(5)已知: a.废水中氰化钠的最高排放标准为0.50mg/L;
b.Ag++2CN-==[Ag(CN)2]-,Ag++I-=AgI↓,AgI 呈黄色,且CN-优先与Ag+反应。
实验如下: 取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用________(填仪器名称) 盛装; 滴定终点时的现象是______________。
②处理后的废水是否达到排放标准_______(填“是”或“否”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是某品牌食用碘盐包装上的部分文字,下列叙述不正确的是

A. 包装上的(以I计)中的“I”指的是碘元素
B. 碘酸钾溶于水的电离方程式为:KIO3===K++I—+O2—
C. 人体缺碘可引起甲状腺肿大
D. 待食品熟后加入可有效防止碘酸钾分解
查看答案和解析>>
科目: 来源: 题型:
【题目】磷能形成多种含氧酸。
(1)一元中强酸次磷酸(H3PO2)是一种精细化工产品,向10 mL H3PO2溶液中加入10 mL等物质的量浓度的NaOH溶液后,所得的溶液中只有H2PO2-、OH-两种阴离子。
① 写出H3PO2溶液与足量NaOH 溶液反应后形成的正盐的化学式:_______,该正盐溶液中各离子浓度由大到小的顺序为____________。
② 若25℃时,K (H3PO2) = 1×10-2,则0.01 mol · L-1的H3PO2溶液的pH =________。
(2)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数为K1= 3.7×10-2、K2=2.6×10-7。
试从电离平衡移动的角度解释K1、K2数据的差异______________。
(3) 25 ℃时,HF的电离常数为K = 3.6×10-4; H3PO4的电离常数为K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13。足量NaF溶液和H3PO4溶液反应的离子方程式为______。
(4)相同温度下,等物质的量浓度的上述三种磷的含氧酸中。c(H+)由大到小的顺序为______________________________________________________(用酸的分子式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】M为一种香料的中间体。实验室由芳香烃A制备M的一种合成路线如下:

已知:

(R1、R2、R3表示烃基或氢原子)
(1)A的结构简式为__________。B的化学名称为____________________。
(2)C中所含官能团的名称为__________。
(3)F→G、G+H→M的反应类型分别为__________、__________。
(4)E→F的第一步反应的化学方程式为____________________。
(5)同时满足下列条件的E的同分异构体有__________种(不考虑立体异构)。
①属于芳香族化合物
②既能与新制Cu(OH)2反应生成砖红色沉淀,又能发生水解反应
其中核磁共振氢谱显示有4组峰的结构简式为______________________________。
(6)参照上述合成路线和信息,以1,3一环己二烯为原料(无机试剂任选),设计制备聚丁二酸乙二酯的合成路线:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用木炭粉和水蒸气在高温条件下反应制取H2,同时生成CO2。某学习小组在实 验室中模拟H2的工业生产过程并测定其产率,实验装置如下所示。

(1)仪器a的名称为_______________。仪器b的作用为____________________________。
(2)实验步骤:连接好装置,检查装置的气密性;______________________(按顺序填入下列步骤的序号)。
①向装置A、B、C、D中分别加入相应试剂,打开活塞K,通入一段时间N2。
②加热装置B处硬质玻璃管。
③关闭活塞K,连接盛有适量水的量气管。
④点燃装置A处酒精灯。
⑤待装置B处木炭粉完全反应后,停止加热。
(3)装置B处硬质玻璃管中发生的所有反应的化学方程式为______________________。
(4)读取B气管读数时,应注意的事项为冷却至室温、___________、视线与凹液面最低点相切;若仰视读取初始读数,则导致所测气体的体积___________(填“偏大”或“偏小”)。
(5)实验后所域取的气体体积为V2 mL标准状况);取装置C中液体,加入足量BaCl2溶液,过滤、洗涤,将滤液和洗涤液合并,以甲基橙为指示剂,用0.1000molL-1的盐酸标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为V3mL。
①达到滴定终点时的现象为____________________________________________。
②H2的产率为______________________(列出代数式即可)。
③还可通过___________,得出装置C中所吸收产物的物质的量。
(6)从安全角度考虑,该实验装置的缺陷为_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol NH3气体(假设生成气体完全逸出),同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体(已知难溶性碱受热易分解,生成相应的金属氧化和水,如 M(OH)n![]() MOn/2+
MOn/2+![]() H2O)向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
H2O)向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在3种离子
B.CO32-、K+一定不存在
C.SO42-、NH4+、Fe3+一定存在,Cl-可能不存在
D.Cl- 一定存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com