
科目: 来源: 题型:
【题目】常温下,下列说法不正确的是
A. 物质的量浓度相同的NaOH溶液和氨水:c(Na+)>c(NH4+)
B. 物质的量浓度相同的盐酸和醋酸溶液,前者c(OH-)更小
C. 将相同体枳相同物质的量浓度的NaOH溶液和醋酸溶液混合后呈碱性,说明醋酸是弱电解质
D. pH=3的盐酸和pH=11的氨水混合后pH>7,说明氨水是弱电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”。因此,不少汽车都安装尾气净化装置(净化处理过程如图)。下列有关叙述,错误的是
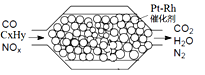
A. 尾气造成“雾霾”与汽油未充分燃烧有关
B. 尾气处理过程,氮氧化物(NOX)被还原
C. Pt-Rh催化剂可提高尾气净化反应的平衡转化率
D. 使用氢氧燃料电池作汽车动力能有效控制雾霾
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
| Ⅰ | ⅰ.先加1mL 0.1 mol/L FeSO4溶液 ⅱ.再加硫酸酸化的KMnO4溶液 | ⅰ.无明显现象 ⅱ.先变红,后褪色 |
Ⅱ | ⅲ.先加1mL 0.05 mol/L Fe2(SO4)3溶液 ⅳ.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | ⅲ.溶液变红 ⅳ.红色明显变浅 |
(1)SCN-存在两种结构式,分别为N≡C—S-和S=C=N-,SCN-是二者的互变异构的混合物,请写出N≡C—S-的电子式__________。
(2)用离子方程式表示FeSO4溶液显酸性的原因__________。
(3)①用离子方程式表示实验Ⅰ溶液变红的原因____________________________。

②针对实验Ⅰ中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如如图实验装置证实了猜想是成立的。其中X溶液是_______,Y溶液是_______,检验产物SO42-的操作及现象是_____________。
(4)针对实验Ⅱ“红色明显变浅”的现象,实验小组进行探究。
甲同学查资料得知:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN-![]() [Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
乙同学认为SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN-![]() [Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:
[Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:

由此推测,实验Ⅱ“红色明显变浅”的原因是___________________。
(5)工业上测定钛铁合金中钛含量的其中一步反应原理是:以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(Ⅲ),反应的化学方程式为:Ti2(SO4)3+2NH4Fe(SO4)2===2Ti(SO4)2+(NH4)2SO4+2FeSO4,则达到滴定终点的实验现象是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】尿素[CO(NH2)2] 是首个由无机物合成的有机化合物,通常用作植物的氮肥。合成尿素的主要反应如下:
i. 2NH3(l) + CO2(g) ![]()
![]() (l)(氨基甲酸铵) △H=-a kJ/mol
(l)(氨基甲酸铵) △H=-a kJ/mol
ii. ![]() (l)
(l) ![]()
![]() (l) + H2O(l) △H=+b kJ/mol
(l) + H2O(l) △H=+b kJ/mol
iii. 2![]()
![]()
![]() (缩二脲)+NH3 (副反应,程度较小)
(缩二脲)+NH3 (副反应,程度较小)
(1)实验室制取氨气的化学方程式是__________________。
(2)CO(NH2)2中C为+4价,N的化合价_______。
(3)CO2和NH3合成尿素的热化学方程式为___________________________。
(4)工业上提高氨碳比(![]() ),可以提高尿素的产率,结合反应i~iii,解释尿素产率提高的原因______。
),可以提高尿素的产率,结合反应i~iii,解释尿素产率提高的原因______。
(5)某科研小组模拟工业合成尿素,一定条件下,在0.5L的密闭容器中投入4molNH3和1molCO2,测得反应中各组分的物质的量随时间变化如图1所示:

①反应进行到10min时,用CO2表示反应i的速率υ(CO2)=________。
②合成总反应的快慢由慢的一步决定,则合成尿素的总反应的快慢由第______步反应决定(填“i”或“ii”)。
(6)我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图2)。总反应为:CO(NH2)2+H2O![]() 3H2↑+N2↑+CO2↑。
3H2↑+N2↑+CO2↑。
①A电极连接电源的_______极(填“正”或“负”)。
②A电极的电极反应为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中,可逆反应: mA(气)+nB(气) ![]() pC(气)+qD(气),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化, ②体系的密度不再发生变化, ③各组分的物质的量浓度不再改变, ④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是
pC(气)+qD(气),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化, ②体系的密度不再发生变化, ③各组分的物质的量浓度不再改变, ④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是
A. ③④ B. ②③④ C. ①②③④ D. ①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合硫酸铁(简称PFS或聚铁)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁(![]() )的工艺流程如下:
)的工艺流程如下:
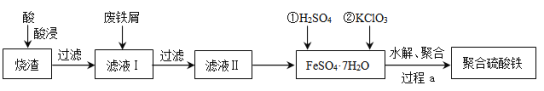
(1)酸浸时最合适的酸是_____(写化学式)。
(2)酸浸后溶液中主要的阳离子有_____。
(3)加入KClO3的目的是_____________________________(结合离子方程式说明)。
(4)过程a中生成聚合硫酸铁的过程是先水解再聚合。将下列水解反应原理的化学方程式补充完整。
_____Fe2(SO4)3+_____H2O![]() ______Fe2(OH)x(SO4)3-
______Fe2(OH)x(SO4)3-![]() + _____ ______
+ _____ ______
(5)过程a中水解要严控pH的范围。pH偏小或偏大聚合硫酸铁的产率都会降低,请解释原因__________。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。盐基度B的表达式:![]() (n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
(n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
ⅰ.取聚合硫酸铁样品m g,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应。然后以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V mL。
ⅱ.做空白对照实验,取与步骤ⅰ等体积等浓度的盐酸,以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0 mL。
①该聚合硫酸铁样品中n(OH-) =_________mol。
②已知该样品中Fe的质量分数w,则盐基度B=_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物I(戊巴比妥)是临床常用的镇静、麻醉药物,其合成路线如下:

已知:R、R、R代表烃基,R代表烃基或氢原子。
ⅰ. 
ⅱ. ![]()
ⅲ. 
回答下列问题:
(1)F→G的反应类型是_________________。
(2)A的化学名称是_____________________。
(3)试剂a的结构简式_____________________。
(4)I的结构简式_____________________。
(5)B、C互为同分异构体,写出B→D的化学方程式_____________________。
(6)写出E→F的化学方程式_____________________。
(7)以A和另一种有机化合物及必要的无机试剂可合成B,则B的合成路线为______。
(用结构简式表示有机化合物,用箭头表示转化关系,箭头上或下注明试剂和反应条件)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,将22.4LHCl完全溶于1L水中(水的密度近似为1g/mL),溶液的密度为ρg/cm3(ρ>1),溶液的体积为VmL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
①w=![]() ×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
A.①②B.②③C.①③D.①④
查看答案和解析>>
科目: 来源: 题型:
【题目】在浓度均为4.0 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的锌粉,充分反应后生成气体体积比为2∶3,则加入锌粉的质量是
A. 6.5 g B. 13.0 g C. 19.5 g D. 26.0 g
查看答案和解析>>
科目: 来源: 题型:
【题目】资料显示:自催化作用是指反应产物之一使该反应速率加快的作用。用稀硫酸酸化的KMnO4进行下列三组实验,一段时间后溶液均褪色(0.01mol/L可以记做0.01M)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A. 实验①中发生氧化还原反应,H2C2O4是还原剂,产物MnSO4能起自催化作用
B. 实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C. 实验③褪色比①快,是因为Cl—的催化作用加快了反应速率
D. 若用1mL0.2M的H2C2O4做实验①,推测比实验①褪色快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com