
科目: 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH=________(填“<”、“>”或“=”)0。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=________mol·L-1,C的物质的量为________mol;若反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol 氩气,平衡时A的转化率为________。
(3)判断该反应是否达到平衡的依据为________。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1200 ℃时,反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】异黄酮类化合物在杀虫方面特别对钉螺有较好的杀灭作用,我国科学家研究了一种异黄酮类化合物的合成路线如下:

回答下列问题:
(1)A的化学名称为 ______。
(2) B中含氧官能团的名称是_____。
(3) B到C的反应类型是_____。
(4)写出C与足量氢氧化钠溶液反应的化学方程式_____。
(5) D的结构简式为_____。
(6)写出与B互为同分异构体的能使Fe3+显色且能发生水解反应的化合物的结构简式(核磁共振氢谱为四组峰,峰面积比为1 : 2 : 2 : 3) _____。
(7)请设计由苯酚和溴丙烷为起始原料制备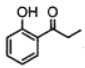 的合成路线(无机试剂任选) _____。
的合成路线(无机试剂任选) _____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为某试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸 | |
分子式 | HCl |
相对分子质量 | 36.5 |
密度 | 1.19g/mL |
HCl的质量分数 | 36.5% |
(1)该浓盐酸中HCl的物质的量浓度为_____molL﹣1。
(2)某学生欲用上述浓盐酸和蒸馏水配制450mL,物质的量浓度为0.400molL﹣1的稀盐酸,需用到的玻璃仪器有:烧杯,玻璃棒,胶头滴管,量筒,_____。该学生需要量取_____mL上述浓盐酸进行配制。
(3)在容量瓶的使用方法中,下列操作不正确的是_____(填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,用胶头滴管加蒸馏水到标线
D.摇匀后,容量瓶内溶液的液面下降,无需再加水
(4)定容时仰视刻度线,对所配制的稀盐酸的物质的量浓度有何影响?_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,用化学用语回答下列有关问题。

(1)其中属于阴离子的是_____;
(2)其中化学性质最稳定的是_____;
(3)已知A元素的某种核素的中子数为18,该核素的符号是_____;
(4)某元素的原子核外有3个电子层,最外层比次外层少2个电子,该元素的离子结构示意图为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】N和S是重要的非金属元素,聚氮化硫(SN)x是重要的超导材料,目前己成为全球材料行业研究的热点。回答下列问题:
(1)下列电子排布图能表示氮原子的最低能量状态的是_____(填字母)。
A.![]() B.
B.![]()
C.![]() D.
D.
(2)S原子的基态原子核外有____个未成对电子,有__________种不同形状的电子云。
(3) S、N、O三种元素的第一电离能由大到小的顺序为________,列举一种与SCN-互为等电子体的分子为_______。
(4) (CH3)3N中N原子杂化方式为_______;As与N是同主族元素,AsH3的相对分子质量比NH3大,实验测得AsH3沸点比NH3低,其原因是___________。
(5) GaN是一种重要的半导体材料,其晶胞结构和金刚石类似,其晶胞结构如图。

①氮化镓中氮原子与镓原子之间以_______键相结合,与同一个Ga原子相连的N原子构成的空间构型为_______。
②GaN晶体的晶胞边长为a pm,摩尔质量为M g/mol,阿伏加德罗常数的值为NA,则GaN晶体的密度为_______gcm-3 (只要求列算式,不必计算出结果,1pm=l0-12m)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)=___________。
(2)HA的电离平衡常数K=______________;
(3)由HA电离出的c(H+)约为水电离出的c(H+)的________倍。
Ⅱ.室温下,有一pH = 12的NaOH溶液100 mL ,欲使它的pH降为11。
(1)如果加入蒸馏水,就加入__________mL
(2)如果加入pH = 10的NaOH溶液,应加入_________ mL
(3)如果加入0.008 mol/L HCl溶液,应加入___________ mL
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010,下列有关说法中正确的是( )
A. 溶液的pH=4
B. 加蒸馏水稀释后,c(HA)/c(A-)减小
C. 向体积和pH均相等的HA溶液与盐酸中加入足量锌,盐酸中产生的气体多
D. 在NaA溶液中存在浓度关系:c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车发动机工作时会产生包括CO、NOx等多种污染气体,涉及到如下反应:
①N2(g)+O2(g)![]() 2NO(g)
2NO(g)
②2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
③NO2(g)+CO(g)![]() CO2(g)+NO(g)
CO2(g)+NO(g)
弄清上述反应的相关机理,对保护大气环境意义重大,回答下列问题:
(1)请根据下表数据填空:N2(g)+O2(g) ![]() 2NO(g) △H=________。
2NO(g) △H=________。
物质 | N2 | O2 | NO |
能量(kJ) | 946 | 497 | 811.25 |
(断开1mol物质中化学键所需要的能量)
(2)实验测得反应2NO(g)+O2(g)![]() 2NO2(g) △H<0的即时反应速率满足以下关系式:
2NO2(g) △H<0的即时反应速率满足以下关系式:
v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响
①温度为T1时,在1L的恒容密闭容器中,投入0.6 molNO和0.3 molO2达到平衡时O2为0.2 mol;温度为T2时,该反应存在k正=k逆,则T1_______ T2 (填“大于”、“小于”或“等于”)。
②研究发现该反应按如下步骤进行:
第一步:NO+NO![]() N2O2 快速平衡 第二步:N2O2 +O2
N2O2 快速平衡 第二步:N2O2 +O2![]() 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v1正=k1正×c2(NO);v1逆=k1逆×c(N2O2)
下列叙述正确的是______
A.同一温度下,平衡时第一步反应的![]() 越大反应正向程度越大
越大反应正向程度越大
B.第二步反应速率低,因而转化率也低
C.第二步的活化能比第一步的活化能低
D.整个反应的速率由第二步反应速率决定
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g) =4CO2(g)+N2(g) △H<0
某温度下,向10L密闭容器中分别充入0.1molNO2和0.2 molCO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
回答下列问题:
①在此温度下,反应的平衡常数Kp=_________kPa-1(Kp为以分压表示的平衡常数,计算结果精确到小数点后2位);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡_____(填“右移”或“左移”或“不移动”);
②若将温度降低,再次平衡后,与原平衡相比体系压强(p总)如何变化?_______(填“增大”、“减小”或“不变”),原因是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锰酸锂离子蓄电池是第二代锂离子动力电池。一种以软锰矿浆(主要成分为MnO2,含少量 Fe2O3、FeO、A12O3、SiO2等杂质)为原料制备锰酸锂的流程如下图所示。

(1)溶浸生产中为提高SO2回收率可采取的措施有_________(填序号)
a.不断搅拌,使SO2和软锰矿浆充分接触
b.增大通入SO2的流速
c.减少软锰矿浆的进入量
d.减小通入SO2的流速
(2)已知:室温下,Ksp[A1(OH)3]=1×10-33,Ksp[Fe(OH)3]=l×10-39, pH=7.1 时 Mn(OH)2开始沉淀。氧化除杂时(室温)除去MnSO4液中的Fe3+、Al3+(使其浓度小于1× l0-6mol /L),需调节溶液pH范围为_______。
(3)由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)。请写出发生反应的离子方程式___________。
(4)将MnO2和 Li2CO3按4:1的物质的量比配料,混合搅拌,然后升温至600℃750℃,制取产品LiMn2O4。写出该反应的化学方程式 _____________ 。
(5)锰酸锂可充电电池的总反应为:Li1-xMn2O4+LixC![]() LiMn2O4+C(0<x<1)
LiMn2O4+C(0<x<1)

①充电时,电池的阳极反应式为_________,若此时转移lmole-,则石墨电极将增重______g。
②废旧锰酸锂电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空
(1)已知Cu2O溶于稀硫酸,可得到CuSO4溶液,写出该反应的离子反应方程式_____;
(2)写出经过一步反应能得到Cu3(OH)4SO4的化学方程式(要求非氧化还原反应)_____;
(3)8.4 g N2与9.6 g某单质Rx,所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是__,x值为_____________。
(4)写出溶液中NH4+的检验方法及相应的离子方程式________________、____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com