近期有两件事引起了人们的极大关注.
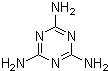
(1)“问题奶粉”①其问题主要是掺杂了三聚氰胺,该物质的结构如图,该物质的含氮量为
66.7%
66.7%
,蛋白质是由不同氨基酸组成的,根据组成的不同,其含氮量一般在15~17.6%之间变化.而农业用氮肥中包括碳酸氢铵、硝酸铵以及尿素,含氮量依次增加,以尿素最高,理论值为
46.7%
46.7%
,现代工业合成三聚氰胺主要使用尿素为原料,在加热和一定压力条件下生成该物质及氨和二氧化碳,试写出化学方程式
6(NH2)2CO═C3H6N6+6NH3↑+3CO2↑
6(NH2)2CO═C3H6N6+6NH3↑+3CO2↑
.
②该物质遇强酸或强碱水溶液水解,氨基逐步被羟基取代,先生成三聚氰酸二酰胺,进一步水解生成三聚氰酸一酰胺,最后生成三聚氰酸.经研究表明三聚氰胺和三聚氰酸在肾细胞中结合沉积从而形成肾结石,堵塞肾小管,最终造成肾衰竭.试写出三聚氰胺生成三聚氰酸的化学方程式
C3H6N6+3H2O=C3N3(OH)3+3NH3
C3H6N6+3H2O=C3N3(OH)3+3NH3
.
(2)“神七问天”①联氨(N
2H
4)是航天飞船常用的高能燃料.联氨是一种无色可燃的液体,溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式:
N
2H
4+H
2O

NH
2NH
3+(N
2H
5+)+OH
-N
2H
4+H
2O

NH
2NH
3+(N
2H
5+)+OH
-.
②联氨也可以采用尿素[CO(NH
2)
2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,写出其反应的化学方程式
CO(NH2)2+NaClO+2NaOH=N2H4+NaCl+Na2CO3+H2O
CO(NH2)2+NaClO+2NaOH=N2H4+NaCl+Na2CO3+H2O
.
③火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热.已知:12.8g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65kJ的热量;H
2O(l)=H
2O (g)△H=+44kJ?mol
-1 2H
2O
2(l)=2H
2O(l)+O
2(g)△H=-196.4kJ?mol
-1则写出表示联氨燃烧热的热化学方程式为
N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-621.23kJ?mol-1
N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-621.23kJ?mol-1
.


 ]2-Na+
]2-Na+ ]2-Na+
]2-Na+
 ,相对分子质量为204.0)是常用的基准物质.某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度.在本实验中达到滴定终点时,溶液的pH约为9.1.
,相对分子质量为204.0)是常用的基准物质.某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度.在本实验中达到滴定终点时,溶液的pH约为9.1. 近期有两件事引起了人们的极大关注.
近期有两件事引起了人们的极大关注. NH2NH3+(N2H5+)+OH-
NH2NH3+(N2H5+)+OH- NH2NH3+(N2H5+)+OH-
NH2NH3+(N2H5+)+OH-