
科目: 来源: 题型:
【题目】部分元素在周期表中的分布如右图所示(虚线为金属元素与非金属元素的分界线),下列说法不正确的是

A. 虚线左侧是金属元素
B. As处于第五周期第VA族
C. Si、Ge可作半导体材料
D. Sb既有金属性又有非金属性
查看答案和解析>>
科目: 来源: 题型:
【题目】改革开放四十年来,我国在很多领域取得了举世瞩目的成就,下列工程使用的部分材料如下所示,其中属于有机高分子的是
A.  港珠澳大桥桥墩——混凝土
港珠澳大桥桥墩——混凝土
B.  “人造太阳”核聚变实验装置——钨合金
“人造太阳”核聚变实验装置——钨合金
C.  高铁轨道与地基之间填隙减震——聚氨酯
高铁轨道与地基之间填隙减震——聚氨酯
D.  “玉兔”月球车太阳能电池帆板——硅
“玉兔”月球车太阳能电池帆板——硅
查看答案和解析>>
科目: 来源: 题型:
【题目】硝苯地平H是一种治疗高血压的药物;其一种合成路线如下:

已知:酯分子中的a-碳原子上的氢比较活泼,使酯与酯之间能发生缩合反应。
![]()
回答下列问题:
(1)B的化学名称为________.
(2)②的反应类型是________.
(3)D的结构简式为________.
(4)H的分子式为________.
(5)反应①的化学方程式为________.
(6)已知M与G互为同分异构体,M在一定条体下能发生银镜反应,核磁共振氢谱显示有4组峰,峰面积之比为1:1:2:4,写出M的一种可能的结构简式________.
(7)拉西地平 也是一种治疗高血压药物,设以乙醇和
也是一种治疗高血压药物,设以乙醇和 为原料制备拉西地平的合成路线(无机试剂任选)。________________________
为原料制备拉西地平的合成路线(无机试剂任选)。________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】钛被誉为“21世纪的金属”,可呈现多种化合价.其中以+4价的Ti最为稳定.回答下列问题:
(1)基态Ti原子的价电子轨道表示式为________.
(2)已知电离能:I2(Ti)=1310kJ/mol,I2(K)=3051kJ/mol.I2(Ti)<I2(K),其原因为________.
(3)钛某配合物可用于催化环烯烃聚合,其结如下图所示:

①铁的配位数为________,碳原子的杂化类型________.
②该配合物中存在的化学键有________(填字母标号).
a.离子健 b.配位键 c.金属健 d.共价键 e.氢键
(4)钛与卤素形成的化合物熔沸点如下表所示:

分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是________.
(5)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为____.阴离子的空间构型为____.

(6)已知TiN晶体的晶胞结构如下图所示,若该晶胞的密度ρg/cm3,阿伏加德罗常数值为NA则晶胞中Ti原子与N原子的最近距离为________pm.(用含ρ、NA的代数式表示)

查看答案和解析>>
科目: 来源: 题型:
【题目】氮的化合物在化肥、医药、炸药、材料等领域中有着极其重要用途。
(1)羟氨能与溴化银悬浊液反应:2NH2OH+2AgBr=N2↑+2Ag+2HBr+2H2O,羟氨的电子式为________;反应中烃氨表现________性.
(2)已知:a.N2(g)+3H2(g)=2NH3(g) △H=-92.2kJ/mol
b.H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ/mol
c.2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) △H3
①△H3________.
②反应c在常温下能快速进行的原因为________.
(3)容积均为1L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器.相同温度下,分别充入0.2mol的NO2,发生反应:2NO2(g)≒N2O4(g) △H<0,甲中NO2的相关量随时间变化如下图所示。
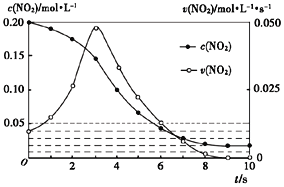
①0~3S内,甲容器中NO2的反应速率增大的原因是________.
②甲达平衡时,温度若为T℃,此温度下的平衡常数Kc=________.
③平衡时,K甲________K乙(填“>”、“<”或“=”,下同),P甲________P乙
(4)化学工作者对NO与H2的反应进行研究,提出下列3步机理:(k为速率常数)
第一步2NO=N2O2 快反应,平衡时:V正=K正·c2(NO)=V逆=K逆·c(N2O2)
第二步N2O2+H2==N2O+H2O 慢反应 第三步N2O+H2=N2+H2O 快反应
其中可近似认为第二步反应不影响第一步平衡,下列说法正确的是________.(填字母标号)
A.V(第一步逆反应)<V(第二步反应) B.总反应快慢主要由第二步反应决定
C.达平衡时,2c(NO)=c(N2O2) D.第一步反应的平衡常数K= K正/ K逆
查看答案和解析>>
科目: 来源: 题型:
【题目】根据能量变化示意图,下列说法正确的是
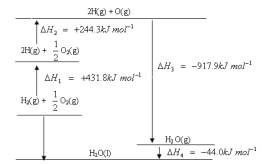
A. H2在O2中燃烧生成气态水的过程中吸收能量
B. 断开1mol H2O(g)所含的共价键共放出917.9kJ的能量
C. H2O(g)比H2O(l)更稳定
D. H2在O2中燃烧生成液态水的热化学方程式为:2H2(g) + O2(g) == 2H2O(l) ![]() H = -571.6 kJ·mol-1
H = -571.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】从工业废钒中回收金属钒既避免污染环境又有利于资源综合利用。某工业废钒的主要成分为V2O5、VOSO4和SiO2等,下图是从废钒中回收钒的一种工艺流程:

(1)为了提高“酸浸”效率,可以采取的措施有________(填两种).
(2)“还原”工序中反应的离子方程式为________.
(3)“沉钒”得到NH4VO3沉淀,需对沉淀进行洗涤,检验沉淀完全洗净的方法是________.
(4)写出流程中铝热反应的化学方程式________.
(5)电解精炼时,以熔融NaCl、CaCl2和VCl2为电解液(其中VCl2以分子形式存在).粗钒应与电源的________极(填“正”或“负”)相连,阴极的电极反应式为________.
(6)为预估“还原”工序加入H2C2O4的量,需测定“酸浸”液中VO2+的浓度.每次取25.00mL“酸浸”液于锥形瓶用a mol/L(NH4)2Fe(SO4)2标准溶液和苯代邻氨基苯甲酸为指示剂进行滴定(其中VO2+ VO2+),若三次滴定消耗标准液的体积平均为bmL,则VO2+的浓度为________g/L(用含a、b的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸亚铁可用于治疗缺铁性贫血。实验室里先制得硫酸亚铁,后将硫酸亚铁与碳酸氢铵反应制得碳酸亚铁(Fe2++2HCO3—===FeCO3↓+CO2↑+H2O)。实验装置如下图所示(部分夹持仪器略去)。回答下列问题:

(1)配制溶液所用的蒸馏水必须先除去溶解的氧气,具体方法是________.
(2)实验过程中,将生成的FeSO4溶液和NH4HCO3溶液混合的操作是________.
(3)装置B中的NH4HCO3需过量的原因________(填字母标号).
a.除去FeSO4溶液中残留的硫酸 b.Fe2+充分转化为FeCO3
c.NH4HCO3溶解度比较大 d.NH4HCO3受热分解损失
(4)碳酸亚铁在潮湿的空气中逐渐被氧化生成氢氧化铁和一种气体,反应的化学方程式为________.
(5)有同学提出该实验可用FeSO4,与Na2CO3反应制取FeCO3,经查阅:0.1mol/LNa2CO3溶液pH约为11.6;25℃时,Ksp[FeCO3]=3.1×10—11,Ksp[Fe(OH)2]=4.9×10—17,向10mL0.1mol/LNa2CO3溶液中滴加0.1mol/L FeSO4溶液,先析出的沉淀是________.
(6)NaHCO3与NH4HCO3均可作为Fe2+的沉淀剂,但更常用NH4HCO3,理由是________。(写出一点即可)
(7)设计实验检验制得的产品中是否含Fe3+________.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. NH4Cl晶体中只含离子键
B. CH4、SiH4、GeH4分子间作用力依次增大
C. 金刚石是原子晶体,加热融化时需克服分子间作用力与共价键
D. NH3和CO2两种分子中,每个原子的最外层都具有8电子稳定结构
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温25℃下,向一定量的0.1mol/L的BOH溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,pC=-1gc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是( )

A. BOH为弱碱且Kb的数量级为10—5
B. b点溶液呈中性
C. c-d点间溶液中:c(BOH)+c(OH—)>c(H+)
D. c点溶液中水的电离程度最大,且c(B+)<c(Cl—)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com