
科目: 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
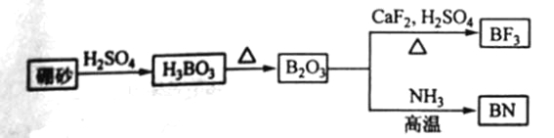
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是

A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3===K2O+xNa2O+16N2↑,
①x=_______________;
②该反应的氧化产物是_________,还原产物是____________,其质量比为_______;
③每生成8个N2转移________个电子;
(2)以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:

①过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是____________。
②过程Ⅰ中,Fe2+催化过程可表示为ⅰ.2Fe2++PbO2+4H++SO![]() ===2Fe3++PbSO4+2H2O ⅱ.……写出ⅱ的离子方程式:____________________________。
===2Fe3++PbSO4+2H2O ⅱ.……写出ⅱ的离子方程式:____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式____。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中P元素的化合价为___。
② 利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为__________(填化学式)。
③从分类来看,NaH2PO2属于______
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式_______Ba(H2PO2)2与H2SO4的离子方程式___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,反应![]() +H2O
+H2O![]() H2CO3+OH的平衡常数K=2.2×108。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
H2CO3+OH的平衡常数K=2.2×108。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
A. 0.2mol·L1氨水:c(NH3·H2O)>c(![]() )>c(OH)>c(H+)
)>c(OH)>c(H+)
B. 0.2mol·L1NH4HCO3溶液(pH>7):c(![]() )>c(
)>c(![]() )>c(H2CO3)>c(NH3·H2O)
)>c(H2CO3)>c(NH3·H2O)
C. 0.2mol·L1氨水和0.2mol·L1NH4HCO3溶液等体积混合:c(![]() )+c(NH3·H2O)=c(H2CO3)+c(
)+c(NH3·H2O)=c(H2CO3)+c(![]() )+c(
)+c(![]() )
)
D. 0.6mol·L1氨水和0.2mol·L1NH4HCO3溶液等体积混合:c(NH3·H2O)+c(![]() )+c(OH)=0.3mol·L1+c(H2CO3)+c(H+)
)+c(OH)=0.3mol·L1+c(H2CO3)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】某固体混合物,仅含有以下阴、阳离子中的某几种(不考虑水的电离):
阳离子 | K+、Ba2+、Ag+、Mg2+、NH |
阴离子 | Cl-、SO |
为了判断该混合物的组成,现依次进行如下实验,根据实验现象,回答下列问题:
(1)取该固体混合物,加水后固体完全溶解得到无色溶液,用pH试纸测得溶液的pH为12,实验中未嗅到刺激性气味。则混合物组成中肯定不存在的离子是________。
(2)向(1)所得溶液中滴加盐酸,有沉淀生成,同时有无色无味气体逸出。则肯定存在的离子是___,可以排除的离子是________。
(3)取(2)实验后的上层清液,滴加AgNO3溶液,有白色沉淀生成。思考还有没有离子尚待检验?请你对尚待检验的离子提出合理的检验方法(要求写出具体的步骤、现象与结论): ________。如果认为没有尚待检验的离子,此空不填。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物Y具有抗菌、消炎作用,可由X制得。

下列有关化合物X、Y的说法正确的是
A. 1 mol X最多能与2 mol NaOH反应
B. Y与乙醇发生酯化反应可得到X
C. X、Y均能与酸性KMnO4溶液反应
D. 室温下X、Y分别与足量Br2加成的产物分子中手性碳原子数目相等
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 一定温度下,反应2H2(g)+O2(g) ![]() 2H2O(g)能自发进行,该反应的ΔH<0
2H2O(g)能自发进行,该反应的ΔH<0
B. 氢氧燃料电池的负极反应为O2+2H2O+4e![]() 4OH
4OH
C. 常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
D. 反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH可通过下式估算:
2H2O(g)的ΔH可通过下式估算:
查看答案和解析>>
科目: 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是

A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B. MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO (s)
MgO (s)
C. S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D. N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com