
科目: 来源: 题型:
【题目】300 ℃时,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 前2 min的平均反应速率v(X)=2.0×10-2 mol/(L·min)
B. 该反应在300 ℃时的平衡常数为1.44
C. 当v逆(Y)=2v正(Z)时,说明反应达到平衡
D. 其他条件不变,再充入0.1 mol X和0.1 mol Y,再次平衡时Y的转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 配制FeCl3溶液时,向溶液中加入少量盐酸
B. 实验室用排饱和食盐水的方法收集氯气
C. 往醋酸溶液中加少量碱,有利于CH3COO-的增多
D. H2、I2、HI平衡时的混合气体加压后颜色变深
查看答案和解析>>
科目: 来源: 题型:
【题目】H2O2在Fe2+、Cu2+的存在下生成具有强氧化性的OH(羟基自由基),OH可将有机物氧化降解。
(1)Cu2+H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)═CuOOH+(aq)+H+(aq)△H1=a kJmol﹣1
CuOOH+(aq)═Cu+(aq)+OH(aq)+1/2O2(g)△H2=b kJmol﹣1
2CuOOH+(aq)═2Cu+(aq)+H2O2(aq)+O2(g)△H3=c kJmol﹣1
则H2O2(aq)═2OH(aq)△H=_____kJmol﹣1。

(2)为探究温度对Cu2+H2O2甲基橙去除率的影响,某研究小组在不同温度下进行实验(其他条件相同),实验结果如图所示。相同条件下,温度升高,甲基橙去除速率增大,其原因是_____。
(3)为探究Fe2+Cu2+H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图所示。得出“Fe2+Cu2+H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为_____。

实验条件:200 mL甲基橙模拟废水(1.5 gL﹣1,pH=3.0),温度60℃、V(H2O2)=2.0 mL
1﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0.4
2﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0
3﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0:0.4
4﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0:0
(4)EFH2O2FeOx法可用于水体中有机污染物降解,其反应机理如下图所示。阳极的电极反应式为_____,X微粒的化学式为_____,阴极附近Fe2+参与反应的离子方程式为_____。

(5)SCOD是指溶解性化学需氧量,是衡量水中有机物质含量多少的指标。水体SCOD越大,说明其有机物含量越高。用Fe2+H2O2法氧化破解啤酒工业污泥中的微生物,释放出有机物和氮等。测得不同初始pH下污泥经氧化破解后上层清液中的SCOD及总氮浓度如上图所示。当pH>2.5时,总氮浓度、SCOD均降低,其原因可能是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe 42.35%、Cr 9.67%、Ni 5.1%、C 4.7%、Si 3.39%等)中制取硫酸镍晶体的工艺流程如下:

已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42﹣转化为Cr2O72﹣。
③相关物质在不同温度时溶解度如下表:
温度溶解度/g物质 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为_____。“酸浸”时需控制温度为90℃左右,可以采用的加热方式是_____。
(2)“过滤”前,适当加热的目的是_____。
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是_____。
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为_____。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,_____,得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应都有水参加,其中属于氧化还原反应,而水既不做氧化剂,又不做还原剂的是( )
A. Na2O + H2O = 2NaOH B. 2Na + 2H2O = 2NaOH + H2 ↑
C. C12 + H2O = HC1O + HC1 D. C + H2O ![]() CO + H2 ↑
CO + H2 ↑
查看答案和解析>>
科目: 来源: 题型:
【题目】KBr可用于光谱分析和化学分析等。
(1)制备KBr的一种方法如下:80℃时,向溶有CO(NH2)2的KOH溶液中缓慢加入Br2,至pH为6~7时反应完全,生成CO2、N2等。该反应的化学方程式为_____。
(2)KBr可用于测定苯酚(C6H5OH)样品的纯度,方法如下:取0.5000g苯酚试样,用NaOH溶液溶解后定容成250.00mL溶液;移取25.00mL该溶液,加入25.00mL0.03000molL﹣1的KBrO3(含过量KBr)标准溶液,然后加入足量盐酸,充分反应后再加足量KI溶液,充分反应;用0.1000molL﹣1Na2S2O3溶液滴定至淡黄色,加入指示剂,继续滴定至终点,用去16.20mL。测定过程中物质的转化关系如下:

①加入的指示剂为_____。
②计算苯酚样品的纯度(写出计算过程)_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氟喹诺酮是人工合成的抗菌药,其中间体G的合成路线如下:

(1)G中的含氧官能团为_____和_____(填名称)。
(2)由C→D的反应类型是_____。
(3)化合物X(分子式为C3H7N)的结构简式为_____。
(4)B和乙醇反应的产物为H(C8H6FCl2NO2),写出满足下列条件的H的一种同分异构体的结构简式:_____。
Ⅰ.是一种α﹣氨基酸;
Ⅱ.分子中有4种不同化学环境的氢,且分子中含有一个苯环。
(5)根据已有知识并结合相关信息,写出以![]() 和ClMgCH(COOC2H5)2为原料制备
和ClMgCH(COOC2H5)2为原料制备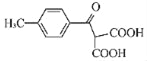 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_____。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液:Na+、Cl-、SO![]() 、Fe3+
、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、MnO![]() 、Cl-
、Cl-
C.pH<7的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO![]() 、Cl-、H+
、Cl-、H+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关事实,与水解反应无关的是
A. 热的纯碱溶液用于清洗油污
B. 氯化铁溶液腐蚀铜板
C. 加热蒸干氯化铁溶液,不能得到氯化铁晶体
D. 用TiCl4和大量水反应,同时加热制备TiO2
查看答案和解析>>
科目: 来源: 题型:
【题目】以硫铁矿烧渣(主要成分Fe2O3、SiO2,少量的Fe3O4、Al2O3、MgO)生产安全高效的水处理剂高铁酸钾(K2FeO4)的工艺流程如下:

已知:FeO42﹣在强碱性溶液中稳定,但在Fe(OH)3催化作用下会发生分解。
(1)“酸浸”时加入硫酸的量不宜过多的原因是_____。
(2)“氧化”时发生反应的离子方程式为_____。
(3)在控制其他条件不变的情况下,探究保持Fe2(SO4)3和NaOH总质量不变,改变其质量比对K2FeO4产率的影响,实验结果如图所示,当质量比大于0.55时K2FeO4的产率下降的原因可能是_____。

(4)“过滤2”产生的滤渣的主要成分为_____(填化学式),“过滤3”所得滤液中含有的阴离子有OH﹣、Cl﹣、SO42﹣、_____、_____(填化学式)。
(5)K2FeO4可将水中的H2S氧化为硫酸盐,同时K2FeO4被还原为Fe(OH)3,则反应时K2FeO4与H2S的物质的量之比为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com