
科目: 来源: 题型:
【题目】可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热 ④分液(在下列空白中填写分离提纯的合理方法的序号及装置下合理的选项)。

(1)除去石灰水中悬浮的CaCO3颗粒:________。
(2)提纯氯化钠溶液中的氯化钠:___。
(3)分离汽油和煤油的混合物:______。
(4)分离水和苯的混合物:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿色”和“生态文明”是未来的发展主题,而CO2的有效利用可以缓解温室效应,解决能源短缺问题;
(1)在新型纳米催化剂 Na-Fe3O4,和HMCM-22的表面将CO2先转化为烯烃再转化为烷烃,已知CO2转化为CO的反应为CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol;
2 CO2 (g)+6H2(g)=C2H4(g)+4 H2O (g) △H=-128kJ/mol
则CO转化为C2H4的热化学方程式为______________________。
(2)用氨水捕捉烟气中的CO2生成NH4CO3。通常情况下,控制反应温度在35℃-40℃范围内的原因___________。
(3)有科学家提出可利用FeO吸收CO2,6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s) K1(平衡常数),对该反应的描述正确的是______
2Fe3O4(s)+C(s) K1(平衡常数),对该反应的描述正确的是______
a.生成 1mol Fe3O4时电子转移总数为2NA
b.压缩容器体积,可增大CO2的转化率,c(CO2)减小
C.恒温恒容下,气体的密度不变可作为平衡的标志
d.恒温恒压下,气体摩尔质量不变可作为平衡的标志
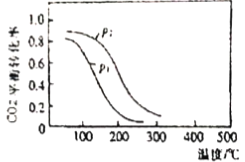
(4)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H,一定条件下,向2L恒容密闭容器中充入1 molCO2和3mo1H2。在不同催化剂作用下发生反应I、反应II、反应II,相同时间内CO2的转化率随温度变化如图所示:
CH3OH(g)+H2O(g) △H,一定条件下,向2L恒容密闭容器中充入1 molCO2和3mo1H2。在不同催化剂作用下发生反应I、反应II、反应II,相同时间内CO2的转化率随温度变化如图所示:

①活化能最小的为___________(填“反应I”、“反应II”、“反应III”)。
②b点反应速率v(正)___________v(逆)(填“>”、“=”或“<”)。
③T4温度下该反应的衡常数___________(保留两位有效数字)
④CO2的平衡转化率与温度、压强的关系如图所示:则该反应为___________(放热反应、吸热反应);P1___________P2(填“>”、“=”或“<”)
(5)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废电池屮的铅膏(主要成PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq),则该反应的平衡常数K=___________(保留两位有效数字):若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将___________(填“增大”、“减小”或“不变”)。
PbCO3(s)+SO42-(aq),则该反应的平衡常数K=___________(保留两位有效数字):若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C. 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
D. 反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/( L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)3g氢气的物质的量为________,在标准状况下的体积为_________。
(2)3.01×1023个S约含_____mol S,其质量为_____g。
(3)49 g H2SO4约含有_____个H,共含有_____个原子。
查看答案和解析>>
科目: 来源: 题型:
【题目】不能用勒夏特列原理解释的是
①打开雪碧的瓶盖,立即有气体逸出
②由H2、I2、HI三种气体组成的平衡体系加压后颜色变深
③可用浓氨水和氢氧化钠固体混合来快速制氨
④煅烧粉碎的硫铁矿有利于SO2生成
⑤使用铁触媒,使N2和H2的混合气体有利于合成NH3
⑥将混合气体中的氨气液化有利于合成氨反应
⑦500℃左右比室温更有利于合成NH3
⑧配制FeCl2溶液时加入少量铁屑
⑨实验室常用排饱和和食盐水法收集Cl2
A. 3项 B. 4项 C. 5项 D. 6项
查看答案和解析>>
科目: 来源: 题型:
【题目】中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银铜合金切割废料中回收银并制备铜化工产品的工艺如下:

注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为___________。
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为___________(写出两种)。
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为______________________。
(4)过滤操作需要的玻璃仪器除烧杯外还有___________。
(5)固体混合物B的组成为___________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为___________。
(6)煅烧阶段通入惰性气体的原因___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向某密闭容器中加入0.2 mol CO和0.2 mol H2O,发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g),4 min时反应达到平衡状态,测得n(CO)∶n(CO2)=3∶2,下列说法正确的是
CO2(g)+H2(g),4 min时反应达到平衡状态,测得n(CO)∶n(CO2)=3∶2,下列说法正确的是
A.缩小容器的体积,混合气体的密度不变
B.v(CO)=v(CO2)时,表明反应达到平衡状态
C.平衡时CO和H2O的转化率相等
D.无法计算该条件下反应的化学平衡常数
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡状态标志的是①单位时间内生成a mol A,同时生成3a mol B;②C生成的速率与C分解的速率相等; ③A、B、C的浓度不再变化;④A、B、C的压强不再变化;⑤混合气体的总压强不再变化;⑥A、B、C的分子数之比为1∶3∶2⑦单位时间内消耗a mol A,同时生成3a mol B;⑧混合气体的物质的量不再变化;
2C(g)达到平衡状态标志的是①单位时间内生成a mol A,同时生成3a mol B;②C生成的速率与C分解的速率相等; ③A、B、C的浓度不再变化;④A、B、C的压强不再变化;⑤混合气体的总压强不再变化;⑥A、B、C的分子数之比为1∶3∶2⑦单位时间内消耗a mol A,同时生成3a mol B;⑧混合气体的物质的量不再变化;
A. ②⑧ B. ①⑥ C. ②④ D. ③⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是
A. H2(g)+![]() O2(g)===H2O(g) ΔH=+242 kJ·mol-1
O2(g)===H2O(g) ΔH=+242 kJ·mol-1
B. 2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ·mol-1
C. H2O(g)===H2(g)+![]() O2(g) ΔH=+242 kJ·mol-1
O2(g) ΔH=+242 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=+484 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2S2O4俗称保险粉,常用做纺织工业的漂白剂、脱色剂等。某科研小组制备并探究其性质。
资料:Na2S2O4易溶于水,具有极强的还原性,易被空气氧化,在碱性介质中稳定。
Ⅰ.制备Na2S2O4 (部分加热等辅助仪器略去)

(1)仪器①的名称是___________。
(2)B装置用于制备Na2S2O4。第一步反应:Zn+2SO2![]() ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为___________。
ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为___________。
(3)实验时,先向B中通入SO2的原因,除产生Zn S2O4之外,另一原因是___________。
(4)反应后除去B中的沉淀,在滤液中加入一定量的NaCl固体搅拌,有Na2S2O4晶体析出。加入NaCl固体的作用是___________
Ⅱ.探究Na2S2O4的性质
(5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是___________。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4,溶液)
(6)制备纳米级银粉用NaOH溶液溶解Na2S2O4,加入一定量的AgNO3溶液,生成纳米级的银粉。在制备银粉的反应中,氧化剂和还原剂的物质的量之比为2:1,且生成的含硫物质只有一种,写出该反应的离子方程式___________。
(7)为测定某含硫代硫酸钠样品的纯度(其它杂质均不参加反应)设计如下方案,并进行实验:
①准确称取该硫代硫酸钠样品mg,配制成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加入少量淀粉溶液,用 nmol·L-1I2标准溶液滴定(发生反应:2S2O32-+I2=S4O32-+2I-),至滴定终点。
③滴定终点的现象为___________,平均消耗I2标准溶液VmL,样品中Na2S2O4的纯度为___________(用代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com